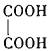题目内容
【题目】草酸亚铁晶体(FeC2O4-2H2O,M=180g.mol-1)为淡黄色固体,难溶于水,可用作电池正极材料磷酸铁锂的原料。回答下列问题:
实验1探究纯草酸亚铁晶体热分解产物
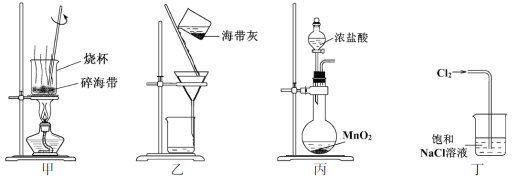
(1)气体产物成分的探究,设计如下装置(可重复选用)进行实验:
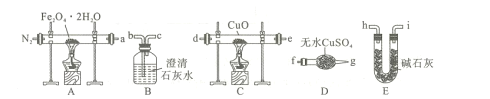
①装置B的名称为 ____。
②按照气流从左到右的方向,上述装置的连接顺序为a→___ →点燃(填仪器接口的字母编号)。
③为了排尽装置中的空气,防止加热时发生爆炸,实验前应进行的操作是____。
④C处固体由黑变红,其后的澄清石灰水变浑浊,则证明气体产物中含有____。
(2)固体产物成分的探究,待固体热分解充分后,A处残留黑色固体。黑色固体可能是Fe或FeO,设计实验证明其成分为FeO的操作及现象为____。
(3)依据(1)和(2)结论,A处发生反应的化学方程式为____。
实验2草酸亚铁晶体样品纯度的测定
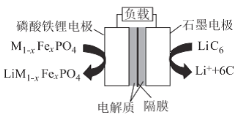
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的流程如下图:

(4)草酸亚铁晶体溶解酸化用KMnO4溶液滴定至终点的离子方程式为____。
(5)草酸亚铁晶体样品的纯度为 ____(用代数式表示),若配制溶液时Fe2+被氧化,则测定结果将____(填“偏高”“偏低”或“不变”)。
【答案】洗气瓶 f g → b c → hi →d e→b c 先通入一段时间的氮气 CO 取少量固体溶于硫酸,无气体生成 ![]()
![]()
 偏低
偏低
【解析】
(1)①根据图示分析装置B的名称;
②先用无水硫酸铜检验水,再用澄清石灰水检验二氧化碳,用碱石灰除去二氧化碳并干燥气体,再用热的氧化铜、澄清石灰水检验CO,最后用点燃的方法处理尾气;
③用氮气排出装置中的空气;
④CO具有还原性,其氧化产物是二氧化碳;
(2)铁与硫酸反应生成氢气,氧化亚铁和硫酸反应不生成氢气;
(3)依据(1)和(2),草酸亚铁晶体加热分解为氧化亚铁、CO、CO2、水;
(4)草酸亚铁被酸性高锰酸钾溶液氧化为Fe3+、CO2;
(5)亚铁离子消耗高锰酸钾溶液V2mL,则草酸根离子消耗高锰酸钾溶液V1mL-V2mL,由于样品含有FeSO4杂质,所以根据草酸根离子的物质的量计算草酸亚铁晶体样品的纯度。
(1)①根据图示,装置B的名称是洗气瓶;
②先用无水硫酸铜检验水,再用澄清石灰水检验二氧化碳,用碱石灰除去二氧化碳并干燥气体,再用热的氧化铜检验CO,再用澄清石灰水检验二氧化碳的生成,最后用点燃的方法处理尾气,仪器的连接顺序是a→fg→bc →hi→de→bc;
③为了排尽装置中的空气,防止加热时发生爆炸,实验前应进行的操作是先通入一段时间的氮气;
④CO具有还原性,C处固体由黑变红,说明氧化铜被还原为铜,其后的澄清石灰水变浑浊,说明有二氧化碳生成,则证明气体产物中含有CO;
(2)铁与硫酸反应生成氢气,氧化亚铁和硫酸反应不生成氢气,取少量固体溶于硫酸,没有气体放出,则证明是FeO;
(3)依据(1)和(2),草酸亚铁晶体加热分解为氧化亚铁、CO、CO2、水,反应方程式是![]() ;
;
(4)草酸亚铁被酸性高锰酸钾溶液氧化为Fe3+、CO2,反应的离子方程式是![]() ;
;
(5)25mL样品溶液中亚铁离子消耗高锰酸钾的物质的量是![]() ,草酸根离子消耗高锰酸钾的物质的量为
,草酸根离子消耗高锰酸钾的物质的量为![]() ,根据方程式
,根据方程式![]() ,草酸亚铁晶体样品的纯度为
,草酸亚铁晶体样品的纯度为 ;若配制溶液时Fe2+被氧化,则V1减小,V2不变,测定结果将偏低。
;若配制溶液时Fe2+被氧化,则V1减小,V2不变,测定结果将偏低。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案