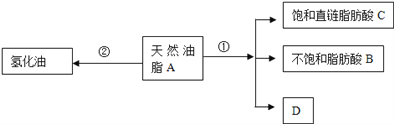
��Ŀ����
����Ŀ����������̼���º���{[Ni(CHZ)3](ClO4)2}��һ�����͵���ҩ��
��1��д����̬Niԭ�ӵ���Χ�����Ų�ͼ___��
��2��Ni����CO�γ������Ni(CO)4������CO���ṩ�µ��ӶԵ���Cԭ�Ӷ�����Oԭ�ӣ������ɿ�����___��1mol������������������ĿΪ___����NAΪ����٤��������ֵ����ͬ����
��3����ClO4-��VSEPRģ����___��
��д����ClO4-��Ϊ�ȵ������һ�ַ��ӣ�___(�ѧʽ)��
��4����������̼���º�����ѧʽ�е�CHZΪ̼���£���ṹΪ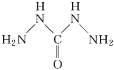 ������һ�����͵Ļ�����¯ˮ��������̼�����е�ԭ�Ӻ�̼ԭ�ӵ��ӻ�������ͷֱ�Ϊ___��___��
������һ�����͵Ļ�����¯ˮ��������̼�����е�ԭ�Ӻ�̼ԭ�ӵ��ӻ�������ͷֱ�Ϊ___��___��
��5����������̼���º�������NiO�������ἰ̼���»��϶��ɡ�
�ٸ����������ǿ�ڴ������ԭ����___��
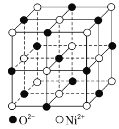
����ͼΪNiO������������Ni2+����λ��Ϊ___����������Ni2+���������O2-֮��ľ���Ϊapm����NiO������ܶ�=___g��cm-3���ú�a��NA�Ĵ���ʽ��ʾ����
���𰸡�![]() �縺��O��C��Oԭ�Ӳ����ṩ�µ��Ӷ� 8NA �������� CCl4 sp3 sp2 ���ǻ����ĸ���Խ�࣬Cl��������Խ�ߣ�����Cl��O��H��O�ĵ���Խ��Clƫ�ƣ�Խ�������H+ 6
�縺��O��C��Oԭ�Ӳ����ṩ�µ��Ӷ� 8NA �������� CCl4 sp3 sp2 ���ǻ����ĸ���Խ�࣬Cl��������Խ�ߣ�����Cl��O��H��O�ĵ���Խ��Clƫ�ƣ�Խ�������H+ 6 ![]()
��������
(1)NiԪ��ԭ�Ӻ�����28�����ӣ�ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d84s2��
(2)�縺��Խ��ԭ��Խ�����ṩ�µ��Ӷԣ�Niԭ���γɵ�4����λ������������CO��N2��Ϊ�ȵ����壬CO���ӽṹʽΪC��O��CO�����к���1��������2��������
(3)��1molClO4����������4mol������
��ԭ��������ͬ���۲���Ӷ�������ȵ����ӻ�Ϊ�ȵ����壻
(4)̼�����е�ԭ����һ�Թµ��Ӷ����γ�3��������̼ԭ���γ�3��������
(5)�ٷ��ǻ�����ĿԽ�࣬����Ԫ�ص�������Խ�ߣ�Խ����������ӣ�
���Զ���Ni2+Ϊ���գ�����Χ�Ⱦ�������������Ӵ������ģ���Ni2+���������O2��֮��ľ���ɼ��㾧���������ɾ����������㾧�����V���ɾ�̯�����㾧����Ni2+��O2������Ŀ���ɼ��㾧������m�����ݾ����ܶ�����![]() ���㡣
���㡣
(1)NiԪ��ԭ�Ӻ�����28�����ӣ�ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d84s2����Χ�����Ų�ͼΪ![]() ��
��
(2)�縺��O��C��Oԭ�Ӳ������µ��Ӷԣ�����CO���ṩ�µ��ӶԵ���Cԭ�ӡ�Niԭ���γɵ�4����λ������������CO��N2��Ϊ�ȵ����壬CO���ӽṹʽΪC��O��CO�����к���1��������2����������Ni(CO)4�к���8��������8��������1 mol �������������� ����ĿΪ8NA��
(3)��1molClO4����������4mol���������ӻ���ʽΪsp3��VSEPR ģ�����������壻
��ԭ��������ͬ���۲���Ӷ�������ȵ����ӻ�Ϊ�ȵ����壬1molClO4��������5molԭ�ӣ��۵���Ϊ32����ȵ�����ΪCCl4��SiF4�ȣ�
(4)̼�����е�ԭ����һ�Թµ��Ӷԣ�ÿ��Nԭ���γ�3�����������ӻ���ʽΪsp3��̼ԭ���γ�3���������ӻ���ʽΪsp2��
(5)��HClO4�з��ǻ�����Ŀ��HClO�Ķ࣬HClO4��Cl�������Ը��ߣ�����Cl��O��H��O�ĵ�����Cl��ƫ�Ƴ̶ȱ�HClO�Ĵ�HClO4�������H+������Խǿ��
���Զ���Ni2+Ϊ���գ�����Χ�Ⱦ�������������Ӵ������ģ���֪Ni2+����λ��Ϊ3��8��![]() ��6����������Ni2+���������O2��֮��ľ���Ϊa pm��������Ϊ2a pm��2a��10��10cm���������V��(2a��10��10)3cm3��������Ni2+��ĿΪ8��
��6����������Ni2+���������O2��֮��ľ���Ϊa pm��������Ϊ2a pm��2a��10��10cm���������V��(2a��10��10)3cm3��������Ni2+��ĿΪ8��![]() +4��
+4��![]() ��4��O2����ĿΪ12��
��4��O2����ĿΪ12��![]() +1��4����������m��
+1��4����������m��![]() ���ʾ����ܶ�����
���ʾ����ܶ�����![]() ��
��![]() gcm��3��
gcm��3��