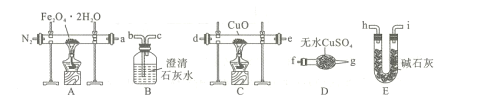
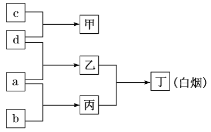
题目内容
【题目】己知:![]() ;常温下,将盐酸滴加到N2H4的水溶液中,混合溶液中pOH[ pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是
;常温下,将盐酸滴加到N2H4的水溶液中,混合溶液中pOH[ pOH=-lgc(OH-)]随离子浓度变化的关系如图所示。下列叙述错误的是
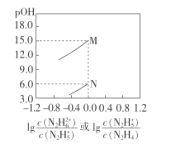
A.曲线M表示pOH与1g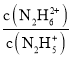 的变化关系
的变化关系
B.反应![]() 的
的![]()
C.pOH1>pOH2
D.N2H5Cl的水溶液呈酸性
【答案】C
【解析】
M、N点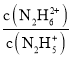 =
= =1,M点c(OH-)=10-15、N点c(OH-)=10-6, M点表示的电离平衡常数=10-15,N点表示的电离平衡常数=10-6;第一步电离常数大于第二步电离常数。
=1,M点c(OH-)=10-15、N点c(OH-)=10-6, M点表示的电离平衡常数=10-15,N点表示的电离平衡常数=10-6;第一步电离常数大于第二步电离常数。
A. 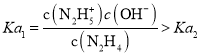 ,所以曲线M表示pOH与1g
,所以曲线M表示pOH与1g 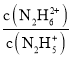 的变化关系,曲线N表示pOH与1g
的变化关系,曲线N表示pOH与1g 的变化关系,故A正确;
的变化关系,故A正确;
B. 反应![]() 表示第二步电离,
表示第二步电离, ![]()
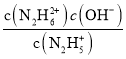 =10-15,故B正确;
=10-15,故B正确;
C. pOH1=![]() 、pOH2=
、pOH2=![]() ,
,![]() ,所以pOH1<pOH2,故C错误;
,所以pOH1<pOH2,故C错误;
D. N2H4是二元弱碱,N2H5Cl是强酸弱碱盐,水溶液呈酸性,故D正确;
故答案选C。

练习册系列答案
相关题目