题目内容
6.a、b、c、d、e 是同周期的五种主族元素,a和b的最高价氧化物的水化物显碱性,且碱性 b>a,c 和 d 的气态氢化物的稳定性 d>c,e 为金属元素.五种元素的原子得失电子后所形成的简单离子中,e 的离子半径最小,则它们的原子序数由小到大的顺序是( )| A. | baecd | B. | edabc | C. | abdce | D. | ebadc |
分析 根据同周期元素从左到右金属性逐渐减弱、非金属性逐渐增强可知a、b,c、d的原子序数关系,根据离子半径的变化规律可知e与a、b、c、d的原子序数关系.
解答 解:a和b的最高价氧化物对应水化物呈碱性,则a、b为金属,且碱性b>a,则周期表中b在a的前面;c和d的气态氢化物的稳定性d>c,即c、d为非金属,根据同周期元素从左到右氢化物的稳定性依次增强,则周期表中d在c的后面;同周期中金属元素在前,非金属性元素在后,则a、b、c、d四种元素大致排序为:b、a、c、d;因为五种元素的原子得失电子后所形成的简单离子中e的离子半径最小,e为金属元素,则原子序数b<a<e(如Na、Mg、Al),所以原子序数由小到大的顺序是b、a、e、c、d.
故选A.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,注意同周期元素的性质的递变规律,注意离子半径的比较方法.

练习册系列答案
相关题目
16.已知XO32-有42个电子,有关X原子的描述正确的是( )
| A. | X原子核外有16个电子 | |
| B. | XO32-有42个质子 | |
| C. | X的氧化物对应的水化物是一种强酸 | |
| D. | X为金属元素 |
17.铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
| A. | 电池的电解液为碱性溶液,负极为Fe | |
| B. | 电池放电过程中,负极附近溶液的pH降低 | |
| C. | 电池放电时,若外电路中有2mol电子转移,则内电路中有2molOH-移向正极 | |
| D. | 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 |
1.金刚石与石墨是碳的两种同素异形体,在100kPa时,1mol石墨转化为金刚石要吸收1.895kJ的热量,下列说法正确的是( )
| A. | 金刚石比石墨稳定 | |
| B. | 石墨比金刚石稳定 | |
| C. | 1mol石墨比1mol金刚石的总能量高 | |
| D. | 1mol金刚石生成1mol石墨要吸收热量 |
下表各组物质中,物质之间不可能实现如下图所示转化的是

选项 | X | Y | Z | M |
A | Fe | FeCl2 | FeCl3 | Cl2 |
B | Mg | C | CO | CO2 |
C | NaOH | Na2CO3 | NaHCO3 | CO2 |
D | NH3 | NO | NO2 | O2 |
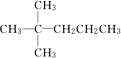 ,并对其命名2,2-二甲基戊烷.其中另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯.
,并对其命名2,2-二甲基戊烷.其中另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯. 2C(g)ΔH<0,下列图象正确的是
2C(g)ΔH<0,下列图象正确的是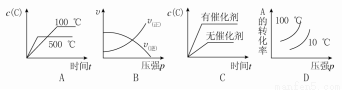
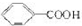
 可以被KMnO4的酸性溶液氧化生成
可以被KMnO4的酸性溶液氧化生成  ,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到
,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不容易被氧化得到  .
. 的异构体共有7种,其中的3种是
的异构体共有7种,其中的3种是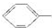 CH2CH2CH2CH2,
CH2CH2CH2CH2,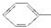 CH(CH2)CH2CH2CH2,
CH(CH2)CH2CH2CH2, CH2CH(CH2)CH2CH2
CH2CH(CH2)CH2CH2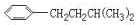 、
、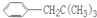 、
、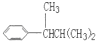 、
、 .
.