题目内容
17.铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )| A. | 电池的电解液为碱性溶液,负极为Fe | |
| B. | 电池放电过程中,负极附近溶液的pH降低 | |
| C. | 电池放电时,若外电路中有2mol电子转移,则内电路中有2molOH-移向正极 | |
| D. | 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 |
分析 铁镍蓄电池放电时Fe作负极,发生氧化反应,失电子生成Fe2+,最终生成Fe(OH)2,负极电极反应为Fe+20H-一2e-═Fe(OH)2,Ni2O3作正极,发生还原反应,最终生成Ni(OH)2,所以正极反应为Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-,据此分析判断.
解答 解:A.根据放电时总反应方程式知放电时Fe作负极,发生氧化反应,失电子生成Fe2+,最终生成Fe(OH)2,所以电池的电解液应该为碱性溶液,Fe作负极,故A正确;
B.放电时Fe作负极,发生氧化反应,失电子生成Fe2+,最终生成Fe(OH)2,负极电极反应为Fe+20H-一2e-═Fe(OH)2,消耗氢氧根离子,所以负极附近溶液的pH降低,故B正确;
C.根据反应电池放电时,正极上得电子发生还原反应,电极反应式为Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-,若外电路中有2mol电子转移,则内电路中有2molOH-移向负极,故C错误;
D.放电时Fe作负极,发生氧化反应,失电子生成Fe2+,最终生成Fe(OH)2,负极电极反应为Fe+20H-一2e-═Fe(OH)2,故D正确;
故选C.
点评 本题考查电池的工作原理,涉及到原电池的有关知识,做题时注意根据总反应从氧化还原的角度判断化合价的变化,以得出电池的正负极以及所发生的反应,题目难度中等.

练习册系列答案
相关题目
8.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)B基态原子中能量最高的电子所处的能级为2p其电子云在空间有3个方向,原子轨道呈纺锤形;
(2)某同学根据上述信息,推断C基态原子的核外电子排布为,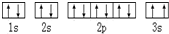 ,该同学所画的电子排布图违背了泡利不相容原理
,该同学所画的电子排布图违背了泡利不相容原理
(3)G位于ⅦB族d区,价电子排布式为3d54s2
(4)DE3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其空间构型为三角锥形
(5)1mol(SCN)2分子中含有σ键的数目为5NA;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键.
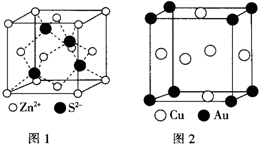
(6)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为4.
(7)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为$\frac{389}{{N}_{A}×{a}^{3}×1{0}^{-21}}$(用含“a、NA 的代数式表示)g•cm-3.

| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 G在周期表的第七列 |
(2)某同学根据上述信息,推断C基态原子的核外电子排布为,
 ,该同学所画的电子排布图违背了泡利不相容原理
,该同学所画的电子排布图违背了泡利不相容原理(3)G位于ⅦB族d区,价电子排布式为3d54s2
(4)DE3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其空间构型为三角锥形
(5)1mol(SCN)2分子中含有σ键的数目为5NA;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键.
(6)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为4.
(7)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为$\frac{389}{{N}_{A}×{a}^{3}×1{0}^{-21}}$(用含“a、NA 的代数式表示)g•cm-3.
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L1mol/L FeCl3溶液中所含Fe3+的数目为NA | |
| B. | 1mol NaHSO4晶体中所含离子的数目为2NA | |
| C. | 1mol NO2溶于足量水中,转移电子的数目为NA | |
| D. | 常温常压下,22.4L HCHO中所含σ键的数目为3NA |
12.下列属于吸热反应的是( )
| A. | 液态水气化 | B. | 氢气燃烧 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(s)混合 |
2.下列各变化中属于原电池反应的是( )
| A. | 在空气中金属铝表面迅速氧化形成保护层 | |
| B. | 锌与稀硫酸反应时,加入少量NaHSO4固体时,可使反应速率加快 | |
| C. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| D. | 镀锌铁表面有划损时,仍然能阻止铁被氧化 |
9.为提纯下列物质(括号内的物质是杂质),所选用的除杂实际和分离方法都正确的是( )
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | SO2(乙炔) | 溴水 | 洗气 |
| B | 苯(溴) | KI溶液 | 分液 |
| C | 乙醇(乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
| D | 乙烷(乙烯) | KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
 CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1molH2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1molH2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是