题目内容
【题目】冬青油又叫水杨酸甲酯,是一种重要的有机合成原料。某化学小组用水杨酸(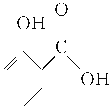 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
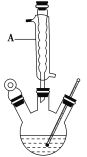
Ⅰ.如图,在三颈烧瓶中加入13.8 g(0.1 mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成共沸物,沸点为85 ℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95 ℃下恒温加热反应1.5小时;
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5% NaHCO3溶液和水洗涤;分离出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221~224 ℃的馏分,得水杨酸甲酯9.12 g。
常用物理常数:
名称 | 分子量 | 颜色状态 | 相对密度 (g·cm-3) | 熔点 (℃) | 沸点 (℃) |
水杨酸 甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 218~ 224 |
水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
请根据以上信息回答下列问题:
(1)仪器A的名称是________,加入沸石的作用是_____________________。若加热后发现未加沸石,应采取的正确方法是________________________________________________。
(2)制备水杨酸甲酯时,最合适的加热方法是____________________________________________。
(3)实验中加入甲苯对合成水杨酸甲酯的作用是___________________________________________。
(4)反应结束后,分离出甲醇采用的方法是__________________________________________。
(5)实验中加入无水硫酸镁的作用是__________________________________________。本实验的产率为________(保留两位有效数字)。
【答案】球形冷凝管防止暴沸停止加热,待冷却后加入水浴加热加入甲苯易将水蒸出,使平衡向右移动,从而提高反应的产率蒸馏或水洗分液除水或干燥60%
【解析】
(1)仪器A的名称是球形冷凝管,加热时为了防止暴沸应加入沸石,若加热后发现未加沸石,应采取的正确方法是停止加热,待冷却后加入,故答案为:球形冷凝管、防止暴沸、停止加热,待冷却后加入;(2)制备水杨酸甲酯时,由于甲醇的沸点是64.7 ℃,为了保证反应物不逸出,所以最合适的加热方法是水浴加热,故答案为:水浴加热;(3)反应产生水杨酸甲酯和水,水杨酸甲酯易溶于甲苯,所以实验中加入甲苯易将水蒸出,使平衡向右移动,从而提高反应的产率,故答案为:加入甲苯易将水蒸出,使平衡向右移动,从而提高反应的产率;(4)甲醇的沸点是64.7 ℃,可以用蒸馏法分离,也可以利用甲醇易溶于水而有机物不溶于水的性质,用水洗分液法分离,故答案为:蒸馏或水洗分液;(5)实验中加入无水硫酸镁的作用是除水,起到干燥的作用;加入0.1 mol水杨酸和0.75 mol甲醇,甲醇过量,以水杨酸为标准计算,理论上产生0.1 mol即15.2 g水杨酸甲酯,实际得水杨酸甲酯9.12 g,所以本实验的产率为![]() ×100%=60%,故答案为:除水或干燥、60%。
×100%=60%,故答案为:除水或干燥、60%。

【题目】用图所示装置检验乙烯时不需要除杂的是
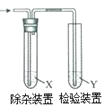
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4共热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
【题目】碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容。
(1)已知热化学方程式:①2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH1
②C(s)+O2(g)===CO2(g) ΔH2
③H2(g)+1/2O2(g)===H2O(l) ΔH3
则反应④2C(s)+H2(g)===C2H2(g)的ΔH=_________。(用含ΔH1、ΔH2、ΔH3的关系式表示)
(2)利用上述反应①设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池的负极反应式:__________________________________________ 。
(3)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH<0。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH<0。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/(mol·L-1) 物质 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①10~20 min内,NO的平均反应速率v(NO)=______,T1℃时,该反应的平衡常数K=________。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是________(填字母编号)。
a.通入一定量的NO b.加入一定量的C c.适当升高反应体系的温度
d.加入合适的催化剂 e.适当缩小容器的体积
③若保持与上述反应前30 min的反应条件相同,起始时NO的浓度为2.50 mol·L-1,则反应达平衡时c(NO)=________,NO的转化率=________。