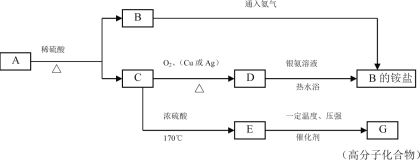
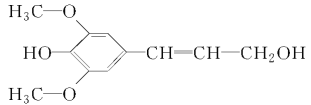
题目内容
【题目】已知A为常见的金属单质,根据下图所示的关系:
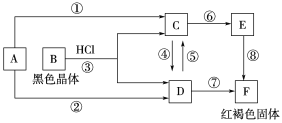
(1)确定A、C、E的化学式:
A.____________, C.____________, F.____________。
(2)写出反应⑧的化学方程式___________________________________,
反应④、⑤的离子方程式______________________、______________________。
【答案】Fe FeCl2 Fe(OH)3 4Fe(OH)2+O2+2H2O===4Fe(OH)3 2Fe2++Cl2===2Fe3++2Cl — 2Fe3++Fe=3Fe2+
【解析】
红褐色固体为氢氧化铁,说明转化关系中含有铁元素,则A为铁。B为黑色晶体,应含有铁元素,为四氧化三铁。据此解答。
红褐色固体为氢氧化铁,说明转化关系中含有铁元素,则A为铁。B为黑色晶体,应含有铁元素,为四氧化三铁,则和盐酸反应生成氯化亚铁和氯化铁,根据转化关系分析,D为氯化铁,C为氯化亚铁,E为氢氧化亚铁。
(1)根据以上分析,A为Fe;C为FeCl2;F为Fe(OH)3;
(2) ⑧为氢氧化亚铁和氧气和水反应生成氢氧化铁,方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 。④为亚铁离子被氯气氧化生成铁离子,离子方程式为: 2Fe2++Cl2=2Fe3++2Cl—;⑤铁离子变成亚铁离子,离子方程式为:2Fe3++Fe=3Fe2+。

 小题狂做系列答案
小题狂做系列答案【题目】溴苯是一种化工原料,实验室用苯和液溴合成溴苯的装置示意图如下(夹持仪器已略去)。请回答以下问题。
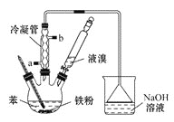
(1)制取溴苯的化学方程式是 ___________,反应过程中烧瓶内有白雾产生,是因为生成了________气体。
(2)该实验中用到冷凝管,由此猜想生成溴苯的反应属于________反应(填“放热”或“吸热”);使用冷凝管时,进水口应是______(填“a”或“b”)。
(3)该实验中将液溴全部加入苯中,充分反应后,为提纯溴苯,进行以下操作:
①将烧瓶中的液体倒入烧杯中,然后向烧杯中加入少量水,过滤,除去未反应的铁屑,过滤时必须用到的玻璃仪器是烧杯、玻璃棒、____________。
②滤液再经一系列处理,最终得到的粗溴苯中仍含有少量苯,要进一步提纯溴苯,可进行的操作是_____(填字母)。
物质 | 苯 | 溴苯 |
沸点/℃ | 80 | 156 |
水中溶解性 | 微溶 | 微溶 |
a.洗涤 b.过滤 c.蒸馏 d.结晶
【题目】冬青油又叫水杨酸甲酯,是一种重要的有机合成原料。某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8 g(0.1 mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成共沸物,沸点为85 ℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95 ℃下恒温加热反应1.5小时;
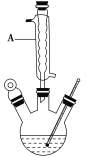
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5% NaHCO3溶液和水洗涤;分离出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221~224 ℃的馏分,得水杨酸甲酯9.12 g。
常用物理常数:
名称 | 分子量 | 颜色状态 | 相对密度 (g·cm-3) | 熔点 (℃) | 沸点 (℃) |
水杨酸 甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 218~ 224 |
水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
请根据以上信息回答下列问题:
(1)仪器A的名称是________,加入沸石的作用是_____________________。若加热后发现未加沸石,应采取的正确方法是________________________________________________。
(2)制备水杨酸甲酯时,最合适的加热方法是____________________________________________。
(3)实验中加入甲苯对合成水杨酸甲酯的作用是___________________________________________。
(4)反应结束后,分离出甲醇采用的方法是__________________________________________。
(5)实验中加入无水硫酸镁的作用是__________________________________________。本实验的产率为________(保留两位有效数字)。