题目内容
【题目】有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大。A元素原子最外层电子数是次外层电子数的2倍,B元素原子最外层电子数等于其电子层数,且为C元素原子最外层电子数的一半。甲为含B的钠盐,乙为C的最高价氧化物对应的水化物,丙为含A的钠盐。 甲、乙、丙、丁四种物质之间的相互反应关系如下图:
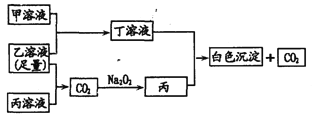
请回答:
(1)写出Na2O2的电子式___________;C在周期表中的位置____________。
(2)用有关化学用语解释丙溶液呈碱性的原因___________________________。
(3)写出甲溶液与足量乙溶液反应的离子方程式: ________________________。
(4)丙和丁因发生双水解而不能共存写出该反应的离子方程式:_____________。
【答案】![]() 第三周期 ⅥA族 CO32-+H2O
第三周期 ⅥA族 CO32-+H2O![]() HCO3-+OH- 4H++AlO2―= Al3++2H2O 2Al3++3CO32-+3H2O= 2Al(OH)3↓+3 CO2↑
HCO3-+OH- 4H++AlO2―= Al3++2H2O 2Al3++3CO32-+3H2O= 2Al(OH)3↓+3 CO2↑
【解析】
A元素原子最外层电子数是次外层电子数的2倍,即A为C,B元素最外层电子数等于其电子层数,三种元素原子序数依次增大,则B为Al,Al的最外层电子式为C原子最外层电子数一半,则C为S,甲为含B的钠盐,即甲为NaAlO2,乙为C的最高价氧化物对应的水化物,则C为H2SO4,丙为含A的钠盐,丙可能为Na2CO3或NaHCO3,然后根据转化关系进行分析即可。
A元素原子最外层电子数是次外层电子数的2倍,即A为C,B元素最外层电子数等于其电子层数,三种元素原子序数依次增大,则B为Al,Al的最外层电子式为C原子最外层电子数一半,则C为S,甲为含B的钠盐,即甲为NaAlO2,乙为C的最高价氧化物对应的水化物,则C为H2SO4,丙为含A的钠盐,丙可能为Na2CO3或NaHCO3,根据转化关系CO2与Na2O2反应生成丙,即丙为Na2CO3,(1)过氧化钠的电子式为![]() ;C为S,位于第三周期VIA族;(2)根据上述分析,丙为Na2CO3,属于强碱弱酸盐,溶液显碱性,是因为CO32-的水解造成, CO32-+H2O
;C为S,位于第三周期VIA族;(2)根据上述分析,丙为Na2CO3,属于强碱弱酸盐,溶液显碱性,是因为CO32-的水解造成, CO32-+H2O![]() HCO3-+OH-;(3)氢氧化铝为两性氢氧化物,NaAlO2溶液中加入过量的H2SO4,离子反应方程式为AlO2-+4H+=Al3++2H2O;(4)根据上述分析,丁溶液为Al2(SO4)3,Al3+和CO32-发生双水解反应,其离子反应方程式为2Al3++3CO32-+3H2O= 2Al(OH)3↓+3CO2↑。
HCO3-+OH-;(3)氢氧化铝为两性氢氧化物,NaAlO2溶液中加入过量的H2SO4,离子反应方程式为AlO2-+4H+=Al3++2H2O;(4)根据上述分析,丁溶液为Al2(SO4)3,Al3+和CO32-发生双水解反应,其离子反应方程式为2Al3++3CO32-+3H2O= 2Al(OH)3↓+3CO2↑。

【题目】某实验小组研究溶液中AgNO3和Na2S的反应。
实验 | 试剂 | 现象 | |
| 试管 | 滴管 | |
(pH = 4) |
(pH = 9) | 出现黑色沉淀 | |
(1)用离子方程式解释Na2S溶液pH > 7的原因:________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为![]() 和
和![]() ;
;
ii.Ag2O能溶解在浓氨水中形成银氨溶液,而Ag2S和Ag均不能。
① 设计并实施如下实验,证实沉淀中含有Ag2S。

试剂1和试剂2分别是_________、_________。
现象1和现象2分别是_________、_________。
② 设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作和现象补充完整。
实验操作 | 实验现象 | |
步骤i | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀,____________ | ____________ |
③ 经检验,沉淀不含有Ag。

(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如右图所示),测得电压为a(![]() )。
)。
对AgNO3溶液中氧化![]() 的物质进行推测:
的物质进行推测:
假设1: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() ;
;
假设2: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() 。
。
利用右图装置继续研究(已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
① 将![]() 的AgNO3溶液替换为_______溶液,记录电压为b(
的AgNO3溶液替换为_______溶液,记录电压为b(![]() )。
)。
② 上述实验证实了氧化![]() 的物质中一定包含
的物质中一定包含![]() ,其证据是______。
,其证据是______。
实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。




