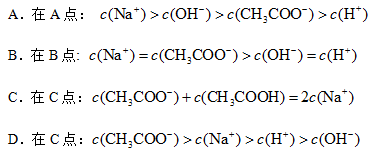题目内容
(4分)现代生活离不开铝,工业上以铝土矿为原料生产铝。现将一定量某铝土矿样品(主要成分Al2O3)溶于过量稀盐酸并制成500 mL溶液。取100 mL该溶液,测得其中含 有H+、Cl―、Mg2+、Al3+、Fe3+ 五种离子(不考虑其它离子)。已知部分离子的物质的量浓度为:
c(H+) = 0.02 mol·L―1 c(Mg2+)= 0.01 mol·L―1
c(Fe3+)= 0.02 mol·L―1 c(Cl―) = 0.52 mol·L―1
(1)溶液中Al3+ 物质的量浓度为 mol·L―1
(2)则该铝土矿样品中Al2O3的质量为 g。(精确至0.01 g)
c(H+) = 0.02 mol·L―1 c(Mg2+)= 0.01 mol·L―1
c(Fe3+)= 0.02 mol·L―1 c(Cl―) = 0.52 mol·L―1
(1)溶液中Al3+ 物质的量浓度为 mol·L―1
(2)则该铝土矿样品中Al2O3的质量为 g。(精确至0.01 g)
(1)0.14mol·L―1 (2)3.57g
试题分析:溶液中,离子的正负电荷守恒,正电荷总数等于负电荷总数,即0.52 mol·L―1 ×0.1L = (0.02 mol·L―1 + 0.01 mol·L―1×2 + 0.02 mol·L―1 ×3 + 3X)×0.1L ,解得Al3+ 物质的量浓度X=0.14mol·L―1 。铝土矿样品溶于稀盐酸,主要反应为Al2O3 + 6HCl ="=" 2AlCl3 + 3H2O,故Al2O3的质量为m =" 102" g/mol×(0.14mol·L―1×0.5L )/2 = 3.57g
点评:本题考查学生对两个守恒的理解,即溶液的电荷守恒和物质的量守恒,找到了这两个守恒,化学方程式的计算就显得很简单。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
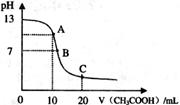
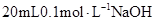 溶液
溶液 中逐滴加入
中逐滴加入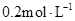 醋酸溶液,pH的变
醋酸溶液,pH的变