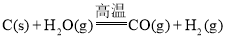题目内容
【题目】下列事实能用勒夏特列原理解释的是( )
A.工业上N2与H2合成NH3,往往需要使用催化剂
B.密闭容器中2molCO与1molH2O(g)充分反应达平衡后,增大压强CO的反应速率加快
C.SO2与O2催化氧化成SO3是一个放热过程,450℃左右的温度比室温更有利于SO3生成
D.向1.50mol/L的硝酸铵溶液中加入少量氨水至中性,水的电离程度减小
【答案】D
【解析】
A. 催化剂只能改变反应速率,从而改变反应到达平衡的时间,但不能使平衡发生移动,A不合题意;
B. 密闭容器中2molCO与1molH2O(g)发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),达平衡后,增大压强CO的浓度增大,反应速率加快,但平衡不发生移动,B不合题意;
CO2(g)+H2(g),达平衡后,增大压强CO的浓度增大,反应速率加快,但平衡不发生移动,B不合题意;
C. SO2与O2催化氧化成SO3是一个放热过程,从平衡移动的角度考虑,应为降低温度有利于SO3生成,但从催化剂的活性考虑,450℃左右的温度比室温更有利于SO3生成,所以不能利用平衡移动原理解释,C不合题意;
D. 向1.50mol/L的硝酸铵溶液中加入少量氨水,将抑制铵根离子水解,从而使水的电离程度减小,D符合题意。
故选D。

练习册系列答案
相关题目
【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()