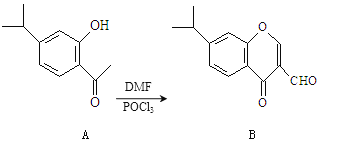
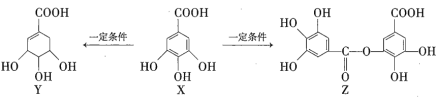
题目内容
【题目】燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放。
(1)用化学方程式表示NO形成硝酸型酸雨的反应______
(2)能作脱除剂的物质很多,下列说法正确的是______
a.用H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
(3)尿素[CO(NH2)2]在一定条件下能有效将NOx转化为N2
Ⅰ.已知可通过下列方法合成尿素:2NH3(g)+CO2(g)![]() H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(l) △H=+28.5kJ/mol
CO(NH2)2(s)+H2O(l) △H=+28.5kJ/mol
①尿素释放出NH3的热化学方程式是______。
②写出有利于尿素释放NH3的条件并说明理由______。
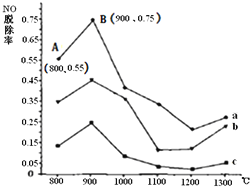
ⅡCO(NH2)2与某种烟气![]() 主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
①曲线a对应CO(NH2)2与NO的物质的量比值是______。
②曲线a、b、c中,800℃~900℃区间内发生主要反应的化学方程式是______。
③900℃~1200℃区间内脱除率下降,NO浓度上升,发生的主要反应是______。
④曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为______mg/(m3·s) 。
【答案】2NO+O2=2NO2,3NO2+H2O=2HNO3+NO ab CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g) △H=+131kJ/mol 升高温度有利于平衡向吸热的正反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行
2NH3(g)+CO2(g) △H=+131kJ/mol 升高温度有利于平衡向吸热的正反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行 ![]() :1 4NH3+6NO
:1 4NH3+6NO![]() 5N2+6H2O或2CO(NH2)2+6NO
5N2+6H2O或2CO(NH2)2+6NO![]() 2CO2+4H2O+5N2 4NH3+5O2
2CO2+4H2O+5N2 4NH3+5O2![]() 4NO+6H2O 1.5×10-4
4NO+6H2O 1.5×10-4
【解析】
(1)NO被O2氧化产生NO2,NO2与水反应产生HNO3和NO;
(2)a.一氧化氮不易溶于水,而二氧化氮易溶于水,反应生成NO;
b.亚硫酸钠不稳定,易被氧气氧化;
c.用CO作脱除剂,则氮氧化物得电子发生还原反应;
(3)Ⅰ.①根据盖斯定律,将两个热化学方程式相加,然后进行颠倒即得目标方程式,其焓变进行相应改变;
②尿素释放NH3的反应是吸热反应,根据温度对化学平衡及氨气溶解度的影响进行分析;
Ⅱ.①CO(NH2)2的含量越高,NO脱除率越高;
②800℃~900℃区间内NO脱除率增大,NO参加反应,即尿素与NO反应生成N2;
③900℃~1200℃区间内脱除率下降,NO浓度上升,反应中应该生成NO;
④A点到B点,NO脱除率由0.55变为0.75,故NO的浓度变化量为(0.75-0.55)×6×10-4 mg/m3=1.2×10-4 mg/m3,再利用![]() 计算NO的脱除速率。
计算NO的脱除速率。
(1)一氧化氮不稳定,易和氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,故NO形成硝酸型酸雨的反应为2NO+O2=2NO2,3NO2+H2O=2HNO3+NO;
(2)a.一氧化氮不溶于水,而二氧化氮易溶于水,反应生成NO,不利于吸收含氮烟气中的NO,a正确;
b亚硫酸钠不稳定,易被氧气氧化,O2会降低Na2SO3的利用率,b正确;
c.用CO作脱除剂,被氧化,则氮氧化物得电子发生还原反应,不生成NO2,烟气中NO2的浓度不增加,c错误;
故答案选ab;
(3)①已知:2NH3(g)+CO2(g)![]() H2NCOONH4(s) △H=-159.5kJ/mol
H2NCOONH4(s) △H=-159.5kJ/mol
H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(l) △H=+28.5kJ/mol
CO(NH2)2(s)+H2O(l) △H=+28.5kJ/mol
根据盖斯定律,将两个热化学方程式相加,整理可得2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l) △H=-131kJ/mol ,所以尿素释放出NH3的热化学方程式为:CO(NH2)2(s)+H2O(l)
CO(NH2)2(s)+H2O(l) △H=-131kJ/mol ,所以尿素释放出NH3的热化学方程式为:CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g) △H=+131kJ/mol;
2NH3(g)+CO2(g) △H=+131kJ/mol;
②根据①分析可知:释放氨气的反应是吸热反应,升高温度,有利于化学平衡向吸热的正反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行;
Ⅱ.①CO(NH2)2的含量越高,NO的转化率越大,即NO脱除率越高,所以曲线a 对应CO(NH2)2 与NO的物质的量比值是3:1;
②800℃~900℃区间内NO脱除率增大,所以NO是作为反应物参加反应,高温时,尿素分解生成氨气、二氧化碳,氨气和一氧化氮发生氧化还原反应生成氮气,即尿素与NO反应生成N2,同时生成二氧化碳和水,所以反应方程式为:4NH3+6NO![]() 5N2+6H2O或 2CO(NH2)2+6NO
5N2+6H2O或 2CO(NH2)2+6NO![]() 2CO2+4H2O+5N2;
2CO2+4H2O+5N2;
③900℃~1200℃区间内脱除率下降,所以NO浓度上升,则该反应中应该有NO生成,尿素分解生成的氨气和烟气中的氧气反应生成一氧化氮和水,导致NO浓度增大,所以反应方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
④A点到B点NO脱除率由0.55变为0.75,则NO的浓度变化量为(0.75-0.55)×6×10-4 mg/m3=1.2×10-4mg/m3,所以NO的脱除速率=![]() =1.5×10-4mg/(m3·s)。
=1.5×10-4mg/(m3·s)。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案