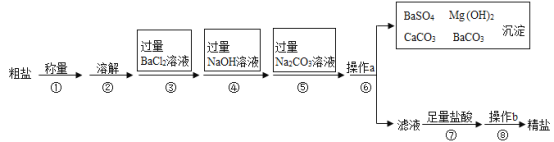
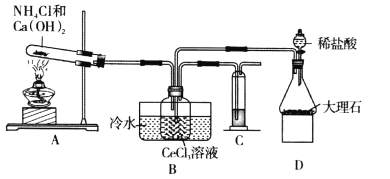
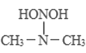
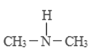题目内容
【题目】黄铁矿(FeS2)催化氧化的化学方程式为:2FeS2+7O2+2H2O 2FeSO4+2H2SO4。已知NA是阿伏加德罗常数的值,下列说法正确的是
2FeSO4+2H2SO4。已知NA是阿伏加德罗常数的值,下列说法正确的是
A.FeSO4和H2SO4都是离子化合物,均属于强电解质
B.0.1 mol·L-1 FeSO4 溶液中Fe2+离子的浓度为0.1 mol·L-1
C.FeSO4既是被氧化得到的产物,又是被还原得到的产物
D.当转移2 mol电子时,消耗氧气的体积(标准状况)约为22.4 L
【答案】C
【解析】
A.FeSO4属于盐,是离子化合物,H2SO4属于酸,是共价化合物,它们均属于强电解质,故A错误;
B.FeSO4溶液中Fe2+离子容易水解,故0.1 mol·L-1 FeSO4溶液中Fe2+离子的浓度小于0.1 mol·L-1,故B错误;
C.根据反应2FeS2+7O2+2H2O 2FeSO4+2H2SO4,FeS2中亚铁离子的化合价为+2价,硫元素的化合价为-1价,单质氧气中氧元素的化合价为0价,硫酸亚铁中,铁元素的化合价为+2价,硫元素的化合价为+6价,氧元素的化合价为-2价,硫元素的化合价升高到+6价,氧气单质中的氧元素的化合价降低到-2价,FeSO4既是被氧化得到的产物,又是被还原得到的产物,故C正确;
2FeSO4+2H2SO4,FeS2中亚铁离子的化合价为+2价,硫元素的化合价为-1价,单质氧气中氧元素的化合价为0价,硫酸亚铁中,铁元素的化合价为+2价,硫元素的化合价为+6价,氧元素的化合价为-2价,硫元素的化合价升高到+6价,氧气单质中的氧元素的化合价降低到-2价,FeSO4既是被氧化得到的产物,又是被还原得到的产物,故C正确;
D.根据反应2FeS2+7O2+2H2O 2FeSO4+2H2SO4可知,7mol氧气参加反应,氧元素化合价从0降低到-2价,共转移28mol电子,当转移2 mol电子时,消耗氧气的物质的量为0.5mol,标准状况下的体积约为0.5mol×22.4 L/mol=11.2L,故D错误;
2FeSO4+2H2SO4可知,7mol氧气参加反应,氧元素化合价从0降低到-2价,共转移28mol电子,当转移2 mol电子时,消耗氧气的物质的量为0.5mol,标准状况下的体积约为0.5mol×22.4 L/mol=11.2L,故D错误;
答案选C。

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目