题目内容
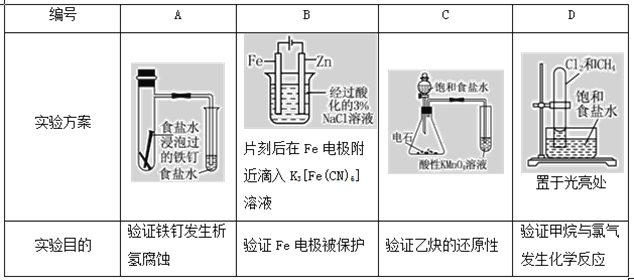
【题目】某矿样用过量酸溶解并过滤,所得滤液A主要含CO32-、Ni2+、SO42-、H+、Fe2+、Fe3+、OH-、Mg2+、Mn2+等九种离子中的七种。将A中金属元素进行分离以备利用,部分流程如图所示:
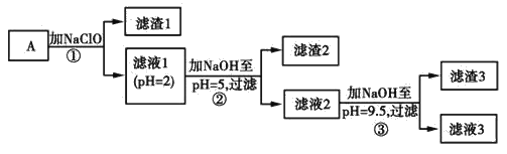
可能用到的有关数据如下:
请根据题给信息填空:
(1)滤液A中不能大量存在的两种离子是________。
(2)已知“滤渣1”是MnO2,步骤①发生的氧化还原反应的离子方程式为________。
(3)常温下,某Ni(OH)2、Mg(OH)2共沉淀的混合体系中,若c(Ni2+)=5.5×10-11mol·L-1,则c(Mg2+)=________。
(4)假定步骤①中NaClO恰好反应,欲检验滤液3中的酸根离子,需优先检验________(填离子符号)。
(5)为测定该矿样中铁元素的含量,取20.0 g矿石,按上述流程操作,将________(填“滤渣1”、“滤渣2”或“滤渣3”)完全酸溶,再使其中的铁元素还原为Fe2+,然后将所得溶液稀释到100 mL,取出20.00 mL用0.100 0 mol·L-1KMnO4溶液滴定。达到滴定终点时溶液颜色为________色,共消耗KMnO4溶液16. 00 mL,经计算矿样中铁元素的质量分数为________。
【答案】CO32-、OH- ClO-+Mn2++H2O===MnO2↓+Cl-+2H+,2H++ClO-+2Fe2+===2Fe3++Cl-+H2O 1.22×10-6mol·L-1 SO42- 滤渣 紫 11.2%
【解析】
矿样用过量酸溶解并过滤,滤液呈酸性,说明一定不含CO32-、OH-,含有七种离子,即含有Ni2+、SO42-、H+、Fe2+、Fe3+、Mg2+、Mn2+,加入NaClO,发生氧化还原反应,生成MnO2,同时Fe2+被氧化生成Fe3+,滤液1中含有Ni2+、SO42-、H+、Fe3+、Mg2+,加入NaOH调节pH=5,根据表中数据可知生成Fe(OH)3,为滤渣2,滤液2中含有Ni2+、SO42-、H+、Mg2+,加入NaOH调节pH=9.5,可生成Mg(OH)2沉淀,为滤渣3,滤液中含有Ni2+、SO42-、Na+、Cl-,由此分析作答。
(1)过量酸处理后,滤液为酸性,故滤液A中不能大量存在CO32-、OH-。
(2)步骤①加入的NaClO为强氧化性物质,溶液中的Mn2+、Fe2+均能被氧化,发生反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-,ClO-+2Fe2++2H+=2Fe3++Cl-+H2O;
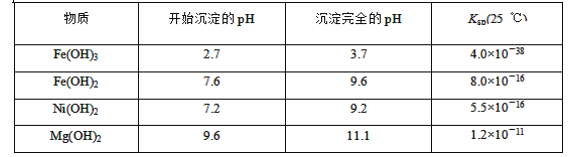
(3)根据题目所给物质的Ksp数据知,溶液中的c2(OH-)= =
=![]() mol2·L-2=1.0×10-5mol2·L-2,因此c(Mg2+)=
mol2·L-2=1.0×10-5mol2·L-2,因此c(Mg2+)=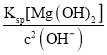 =
=![]() mol·L-1=1.2×10-6mol·L-1;
mol·L-1=1.2×10-6mol·L-1;
(4)通过(1)中离子共存的判断可知溶液中一定含有SO42-,通过步骤①可知生成Cl-,因此滤液3中含有酸根离子为SO42-、Cl-,应先检验SO42-,使之转化为BaSO4沉淀,然后再检验Cl-;若先检验Cl-,则SO42-与Ag+生成微溶的Ag2SO4,影响Cl-的检验;
(5)步骤②调节pH=5,Fe3+生成Fe(OH)3沉淀,因此滤渣2为Fe(OH)3,用酸溶解可得Fe3+,再使其中的铁元素还原为Fe2+,Fe2+可被KMnO4氧化,所以达到滴定终点时溶液颜色为紫色,反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,所以100 mL溶液中n(Fe2+)=5×5×0.1000mol/L×0.01600L=0.04mol,因此矿样中铁元素的质量分数为![]() ×100%=11.2%。
×100%=11.2%。

 名校课堂系列答案
名校课堂系列答案【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
①仪器m的名称为___,装置F中试剂的作用是___。
②装置连接顺序:A→___→E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___(填“可行”或“不可行”),原因是___。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:

①W溶液可以是___(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____(用含V、m的式子表示)。