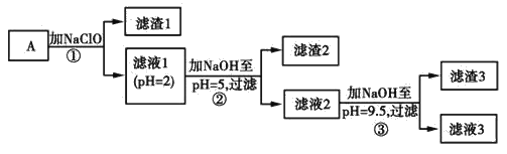
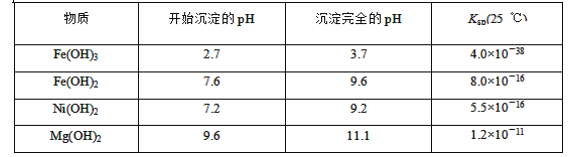
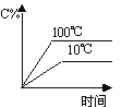
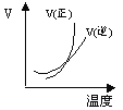
题目内容
【题目】下述实验方案能达到实验目的的是( )
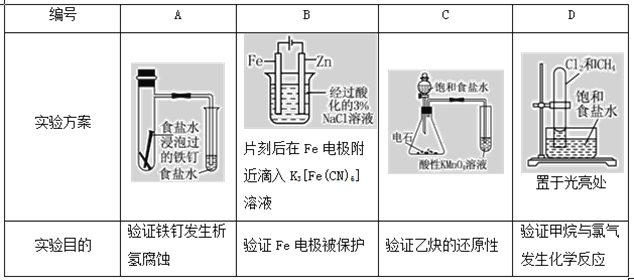
A.A
B.B
C.C
D.D
【答案】D
【解析】
A. 食盐水为中性,发生吸氧腐蚀;
B. Fe与电源正极相连;
C. 电石和水反应生成的乙炔中含有还原性的H2S等杂质,H2S等还原性气体能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色;
D. 光照下甲烷与氯气发生取代反应,生成HCl极易溶于水。
A. 食盐水为中性,发生吸氧腐蚀,该实验方案能达到实验目的,A项错误;
B. Fe与电源正极相连,作阳极,发生氧化反应,Fe电极被腐蚀,B项错误;
C. 电石和水反应生成的乙炔中含有还原性的H2S等杂质,H2S等还原性气体能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,会干扰乙烷的检验,所以无法实现实验目的,C项错误;
D. 光照下甲烷与氯气发生取代反应,生成HCl极易溶于水,装置可验证甲烷与氯气发生化学反应,D项正确;
答案选D。
类型 | 析氢腐蚀 | 吸氧腐蚀 | |
条件 | 水膜酸性较强(pH≤4.3) | 水膜酸性很弱或呈中性 | |
电极反应 | 负极 | Fe-2e-===Fe2+ | |
正极 | 2H++2e-===H2↑ | O2+2H2O+4e-===4OH- | |
总反应式 | Fe+2H+===Fe2++H2↑ | 2Fe+O2+2H2O===2Fe(OH)2 | |
联系 | 吸氧腐蚀更普遍 | ||

【题目】某实验小组做乙醛和新制氢氧化铜的反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
乙醛溶液进行下列实验.
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
(1)上表中a、b应为(填字母序号)。___________________
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是___________。
(4)由实验4可以得出结论:当NaOH的用量较大时,新制氢氧化铜可以与乙醛发生反应,生成Cu2O红色沉淀。该反应的化学方程式为_________。
(5)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是_______________。
(6)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是__________________基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
【题目】下列实验操作及现象能够达到对应实验目的是( )
选项 | 实验操作及现象 | 实验目的 |
A | 向溶液中加入盐酸无现象,再加入氯化钡溶液产生白色沉淀 | 检验溶液中有 |
B | 常温下,向饱和 | 证明常温下, |
C | 常温下,测定盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于 |
D | 将浓硫酸与碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中 |
A.AB.BC.CD.D