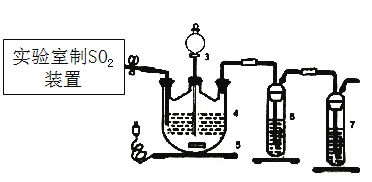
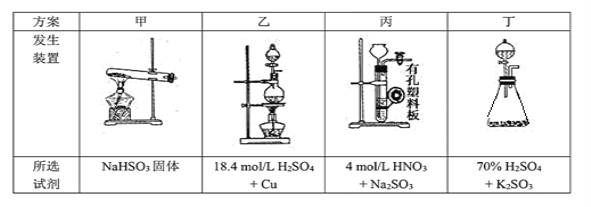
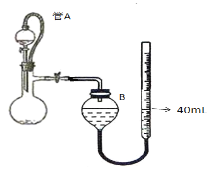
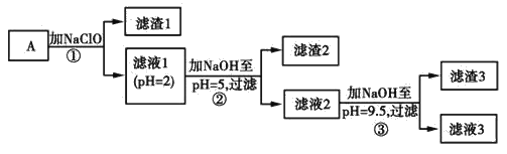
题目内容
【题目】下列由电子排布式所得的结论错误的是![]()
选项 | 电子排布式 | 结论 |
A |
| 违背洪特规则 |
B |
| 违背能量最低原理 |
C |
| 违背泡利原理 |
D |
| 违背能量最低原理 |
A.AB.BC.CD.D
【答案】B
【解析】
![]() 电子排布式为:
电子排布式为:![]() ,此处
,此处![]() ,
,![]() ,
,![]() 就是2p能级的3个简并轨道,两个电子排入2p能级,它们将分别占据2个简并轨道且自旋平行,而不是自旋相反地挤入其中一个轨道,所以A项电子排布是违反洪特规则的,故A正确;
就是2p能级的3个简并轨道,两个电子排入2p能级,它们将分别占据2个简并轨道且自旋平行,而不是自旋相反地挤入其中一个轨道,所以A项电子排布是违反洪特规则的,故A正确;
B.电子排布式为:![]() ,排布符合构造原理,符合三个原理,故B错误;
,排布符合构造原理,符合三个原理,故B错误;
C.电子排布式为:![]() ,3p轨道最多容纳6个电子,不可能出现
,3p轨道最多容纳6个电子,不可能出现![]() 的情况,所以C项电子排布式违反泡利原理,故C正确;
的情况,所以C项电子排布式违反泡利原理,故C正确;
D.电子排布式为:![]() ,虽然3d轨道为半充满结构,但3p上只有2个电子,没有充满,所以D项电子排布式违反能量较低原理,故D正确,
,虽然3d轨道为半充满结构,但3p上只有2个电子,没有充满,所以D项电子排布式违反能量较低原理,故D正确,
答案选B。

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目