题目内容
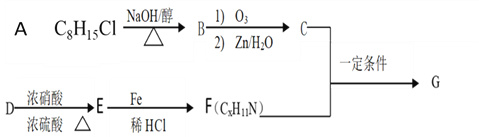
【题目】如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2 , 将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L.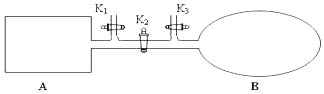
(1)B中除了可通过观察混合气颜色不变的现象判断可逆反应2NO2N2O4已经达到平衡外,还可通过的现象进行判断.
(2)若平衡后在A容器中再充入0.5molNO2 , 则重新到达平衡,新平衡与旧平衡相比,下列物理量减小的有;
A.c(NO2) B.NO2的体积分数 C.NO2的转化率 D. ![]()
若平衡后在B容器中再充入0.5mol NO2 , 则重新到达平衡,新平衡与旧平衡相比,下列物理量增大的有 .
A.NO2的转化率 B.混合气体的平均相对分子质量 C. ![]() D.n(NO2)
D.n(NO2)
(3)若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率υ(NO2)等于 .
(4)若打开K2 , 平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为L.
【答案】
(1)气囊不再变小
(2)BD,D
(3)![]() mol/(L?s)
mol/(L?s)
(4)0.7a
【解析】解:(1)B是一个气体压强不变的容器,所以当反应达到平衡状态时,混合气体的颜色和气囊体积不再改变,说明浓度不变,反应达到平衡状态,
所以答案是:气囊不再变小;
(2)反应2NO2N2O4已经达到平衡,若平衡后在A容器中再充入0.5molNO2,相当于增大压强,平衡正向进行,再加入气体,相当于增大压强,化学平衡正向移动,二氧化氮的百分含量会减小,
A.c(NO2)增大,故A错误;
B.平衡正向进行NO2的体积分数减小,故B正确;
C.平衡正向进行NO2的转化率增大,故C错误;
D.平衡正向进行 ![]() 比值减小,故D正确;
比值减小,故D正确;
故选BD.
若平衡后在B容器中再充入0.5mol NO2,则重新到达平衡,新平衡与旧平衡相比达到相同的平衡状态,
A.达到相同的平衡状态,NO2的转化率不变,故A错误;
B.气体质量和物质的量都不变,混合气体的平均相对分子质量不变,故B错误;
C. ![]() 比值不变,故C错误;
比值不变,故C错误;
D.加入二氧化氮,二氧化氮气体物质的量n(NO2)增大,故D正确;
故选D,
所以答案是:BD;D;
(3)
2NO2 | N2O4 | |
起始(mol) | 1 | 0 |
转化(mol) | 2x | x |
平衡(mol) | 1-2x | x |
则 ![]() =0.8,解得x=0.2mol,
=0.8,解得x=0.2mol,
所以平均化学反应速率v(NO2)= ![]() mol/(Ls)=
mol/(Ls)= ![]() mol/(Ls),
mol/(Ls),
所以答案是: ![]() mol/(Ls);
mol/(Ls);
(4)打开K2,则相当于是在等温等压时的平衡,因此平衡时等效的.由于此时反应物的物质的量是B中的二倍,所以打开K2之前,气球B体积为(aL+0.4aL)÷2=0.7aL,
所以答案是:0.7a.
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征和化学平衡的计算的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4 , 即可得到I2 , 写出该反应的离子方程式 .
(2)一种碘和氧的化合物(I4O9),可以称为碘酸碘,则I4O9中碘元素的化合价是 .
A.﹣1
B.+1
C.+3
D.+5
(3)若IOH是两性化合物,写出IOH的酸式电离的电离方程式 .
(4)已知反应2HI(g)═H2(g)+I2(g)△H=+11kJmol﹣1 , 1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为kJ.
(5)Bodensteins研究了下列反应:2HI(g)H2(g)+I2(g).在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为: .
②上述反应中,正反应速率为υ正=k正x2(HI),逆反应速率为υ逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为(以K和k正表示).
③由上述实验数据计算得到υ正~x(HI)和υ逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为(填字母).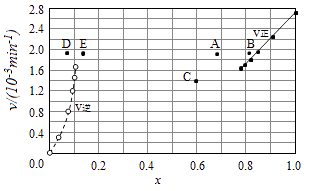
【题目】气体的自动化检测中常常应用原电池原理的传感器.如图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号.下表列出了待测气体及敏感电极上部分反应产物.
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
则下列说法中正确的是( )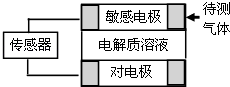
A.上述气体检测时,敏感电极均作电池正极
B.检测Cl2气体时,敏感电极的电极反应为:Cl2+2e﹣═2Cl﹣
C.检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2+2H2O+4e﹣═4OH﹣
D.检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同