题目内容
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)= CH3OH(g),在体积为1L的恒容密闭容器中,充入2 molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图所示。
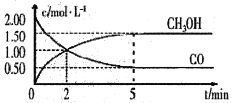
①从反应开始至达到平衡,用氢气表示的平均反应速率υ(H2)=_______mol/(L·min)
②下列说法正确的是______(填字母序号)。
A.达到平衡时,CO的转化率为75%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前υ(正)>υ(逆),2min后υ(正)<υ(逆)
③该条件下反应的平衡常数K=______。
(2)已知:I.CO的燃烧热为△H=-283.0kJ·mol-1
II.H2O(1)=H2O (g) △H=+44.0 kJ·mol-1
III.2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1
则①2CH3OH(g)+CO(g)+![]() O2(g)
O2(g)![]() CH3OCOOCH3(g)+ H2O( l) △H=_____。
CH3OCOOCH3(g)+ H2O( l) △H=_____。
②对于可逆反应2CH3OH(g)+CO(g)+ ![]() O2(g)
O2(g)![]() CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
CH3 OCOOCH3(g)+H2O(1)采取以下措施可以提高CH3OCOOCH3产率的是____(填字母)
A.降低体系的温度 B.压缩容器的体积
C.减少水量 D.选用适当的催化剂
(3)比亚迪双模电动汽车使用高铁电池供电。高铁电池的总反应为:3Zn(OH)+2Fe(OH)3+4KOH![]() 3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
3Zn+2K2 FeO4+8H2O,则充电时的阳极反应式为_______。
(4)若往20mL0.0lmol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是______(填序号)。
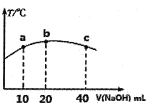
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
【答案】0.6 AB 3 -342.5 kJ·mol-1 AB Fe(OH)3-3e-+5OH-= FeO42-+4H2O ②③
【解析】
(1)①根据速率定义式求算。
② A.根据三段式求算。
B.反应前后气体质量不变,气体物质的量变化,5min后反应达到平衡状态,容器中混合气体的平均相对分子质量不再改变。
C. 达到平衡后,再充入氩气,总压增大分压不变,速率不变。
D.2min前后反应未达到平衡状态,反应正向进行,υ(正)>υ(逆)。
③根据平衡常数K=c(CH3OH)/[c(CO)c2(H2)]求算。
(2)①根据盖斯定律求算。
②2CH3OH(g)+CO(g)+ ![]() O2(g)
O2(g)![]() CH3 OCOOCH3(g)+H2O(1) △H=-342.5 kJ·mol-1,提高CH3OCOOCH3产率,需使平衡右移。
CH3 OCOOCH3(g)+H2O(1) △H=-342.5 kJ·mol-1,提高CH3OCOOCH3产率,需使平衡右移。
(3)充电时阳极上失去电子发生氧化反应。
(4)①②HNO2是弱酸,亚硝酸电离是吸热过程,酸碱中和反应是放热反应,当恰好完全中和时放热最多,根据此确定c(NaOH)。
③电离是吸热,温度越高电离平衡常数越大。
④当c(NaOH)较大时,可能出现c(Na+)>c(OH-) >c(NO2-)>c(H+)。
(1)①从反应开始至达到平衡,υ(CO)=(1.5mol/L)/5min=0.3mol/(Lmin),υ(H2)= 2υ(CO)=0.6 mol/(L·min),故答案为:0.6。
② A. CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起(mol) 2 4 0
转(mol) 1.5 3 1.5
平(mol) 0.5 1 1.5
达到平衡时,CO的转化率为(1.5mol÷2mol)×100%=75%,故A正确;
B.反应前后气体质量不变,气体物质的量变化,5min后反应达到平衡状态,容器中混合气体的平均相对分子质量不再改变,故B正确;
C. 达到平衡后,再充入氩气,总压增大分压不变,速率不变,故C错误;
D.2min前后反应未达到平衡状态,反应正向进行,υ(正)>υ(逆),故D错误;
故选AB。
③该条件下反应的平衡常数K=c(CH3OH)/c(CO)c2(H2)= 1.5/(0.5×12)=3,故答案为:3。
(2)①I.根据CO的燃烧热为△H=-283.0kJ·mol-1,得出CO(g)+1/2O2(g)= CO2(g) △H=-283.0kJ·mol-1①,
II.H2O(1)=H2O (g) △H=+44.0 kJ·mol-1,②
III.2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1③
CH3OCOOCH3(g)+ H2O(g) △H=-15.5 kJ·mol-1③
根据盖斯定律,①-②+③得到2CH3OH(g)+CO(g)+![]() O2(g)
O2(g)![]() CH3OCOOCH3(g)+ H2O( l),△H=-342.5 kJ·mol-1,故答案为:-342.5 kJ·mol-1。
CH3OCOOCH3(g)+ H2O( l),△H=-342.5 kJ·mol-1,故答案为:-342.5 kJ·mol-1。
②2CH3OH(g)+CO(g)+ ![]() O2(g)
O2(g)![]() CH3 OCOOCH3(g)+H2O(1) △H=-342.5 kJ·mol-1,提高CH3OCOOCH3产率,需使平衡右移,
CH3 OCOOCH3(g)+H2O(1) △H=-342.5 kJ·mol-1,提高CH3OCOOCH3产率,需使平衡右移,
A. 降低体系的温度,平衡右移,故A正确;
B. 压缩容器的体积,相当于增大压强,平衡右移,故B正确;
C.水的浓度是个定值,故C错误;
D. 催化剂只能改变反应速率,不能使平衡移动,故D错误;
故选AB。
(3)高铁电池的总反应为:3Zn(OH)+2Fe(OH)3+4KOH![]() 3Zn+2K2 FeO4+8H2O,充电时阳极上失去电子发生氧化反应,故阳极反应式为:Fe(OH)3-3e-+5OH-= FeO42-+4H2O,故答案为:Fe(OH)3-3e-+5OH-= FeO42-+4H2O。
3Zn+2K2 FeO4+8H2O,充电时阳极上失去电子发生氧化反应,故阳极反应式为:Fe(OH)3-3e-+5OH-= FeO42-+4H2O,故答案为:Fe(OH)3-3e-+5OH-= FeO42-+4H2O。
(4)①HNO2是弱酸,亚硝酸电离是吸热过程,酸碱中和反应是放热反应,当恰好完全中和时放热最多,c(NaOH)=(0.02L×0.01mol/L)/0.02L=0.01mol/L,故①错误,②正确;
③电离是吸热,温度越高电离平衡常数越大,所以HNO2的电离平衡常数:b点>a点,故③正确;
④从b点到c点,当c(NaOH)较大时,可能出现c(Na+)>c(OH-) >c(NO2-)>c(H+),故④错误;
故选②③。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】某同学用食用油进行实验,以下是实验操作和现象:
实验操作 | 将食用油滴入水中 | 向食用油中滴加溴水 | 将少量食用油与纯碱(主要成分是 |
实验现象 | 食用油浮在水面上 | 溴水褪色 | 分层现象消失 |
下列关于食用油的实验结论不正确的是( )
A.食用油的密度比水小
B.食用油中含碳碳不饱和键
C.食用油在碱性条件下会水解生成可溶于水的物质
D.食用油是一种有机酸