题目内容
【题目】设![]() 为阿伏加德罗常数的值。下列叙述错误的是
为阿伏加德罗常数的值。下列叙述错误的是![]()
![]()
A.![]() 和
和![]() 中含有的中子数均为
中含有的中子数均为![]()
B.常温常压下,![]() 含甲醛
含甲醛![]() 的冰醋酸中含有的原子总数为
的冰醋酸中含有的原子总数为![]()
C.常温下,![]() 的氨水中,发生电离的水分子数为
的氨水中,发生电离的水分子数为![]()
D.一定条件下,足量氧气通过Na单质后,若固体增重![]() ,则转移的电子数一定为
,则转移的电子数一定为![]()
【答案】D
【解析】
A.10gD2O和10gH218O的物质的量均为0.5mol,含有的中子数均为5NA,故A正确;
B.冰醋酸和甲醛的最简式均为![]() ,3.0g含甲醛的冰醋酸中含0.1molCH2O,含有的原子总数为
,3.0g含甲醛的冰醋酸中含0.1molCH2O,含有的原子总数为![]() ,故B正确;
,故B正确;
C.常温下,1LpH=10的氨水中,水电离出的![]() mol/L,发生电离的水分子数为
mol/L,发生电离的水分子数为![]()
![]() ,故C正确;
,故C正确;
D.氧气与Na单质反应得到的产物可能是氧化钠,也可能是过氧化钠,无法计算转移电子数目,故D错误;
故答案为D。

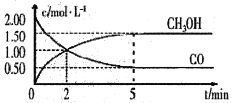
【题目】汽车发动机工作时会产生包括CO、NOx等多种污染气体,涉及到如下反应:
①N2(g)+O2(g)![]() 2NO(g)
2NO(g)
②2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
③NO2(g)+CO(g)![]() CO2(g)+NO(g)
CO2(g)+NO(g)
弄清上述反应的相关机理,对保护大气环境意义重大,回答下列问题:
(1)请根据下表数据填空:N2(g)+O2(g) ![]() 2NO(g) △H=________。
2NO(g) △H=________。
物质 | N2 | O2 | NO |
能量(kJ) | 946 | 497 | 811.25 |
(断开1mol物质中化学键所需要的能量)
(2)实验测得反应2NO(g)+O2(g)![]() 2NO2(g) △H<0的即时反应速率满足以下关系式:
2NO2(g) △H<0的即时反应速率满足以下关系式:
v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响
①温度为T1时,在1L的恒容密闭容器中,投入0.6 molNO和0.3 molO2达到平衡时O2为0.2 mol;温度为T2时,该反应存在k正=k逆,则T1_______ T2 (填“大于”、“小于”或“等于”)。
②研究发现该反应按如下步骤进行:
第一步:NO+NO![]() N2O2 快速平衡 第二步:N2O2 +O2
N2O2 快速平衡 第二步:N2O2 +O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v1正=k1正×c2(NO);v1逆=k1逆×c(N2O2)
下列叙述正确的是______
A.同一温度下,平衡时第一步反应的![]() 越大反应正向程度越大
越大反应正向程度越大
B.第二步反应速率低,因而转化率也低
C.第二步的活化能比第一步的活化能低
D.整个反应的速率由第二步反应速率决定
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g) =4CO2(g)+N2(g) △H<0
某温度下,向10L密闭容器中分别充入0.1molNO2和0.2 molCO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
回答下列问题:
①在此温度下,反应的平衡常数Kp=_________kPa-1(Kp为以分压表示的平衡常数,计算结果精确到小数点后2位);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”);
②若将温度降低,再次平衡后,与原平衡相比体系压强(p总)如何变化?_______(填“增大”、“减小”或“不变”),原因是__________。
【题目】经测定乙醇的分子式是![]() ,由于有机化合物普遍存在同分异构现象,推测乙醇分子的结构可能是下列两种之一:
,由于有机化合物普遍存在同分异构现象,推测乙醇分子的结构可能是下列两种之一:
Ⅰ.  Ⅱ.
Ⅱ. 
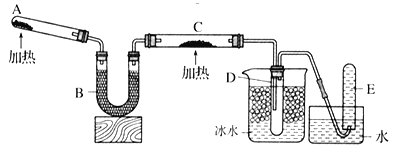
为确定其结构,应利用物质的特殊性质进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,甲、乙、丙三名学生利用如图所示装置进行实验确定乙醇分子的结构。图中量气装置由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~200mL),供量气用;乙管可上下移动,以调节液面高低。
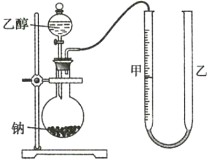
(1)学生甲得到一组实验数据;
乙醇的物质的量 | 氢气的体积(标准状况下) |
0.01mol | 0.112L |
根据以上数据推断,乙醇的结构应为___________________(填“Ⅰ”或“Ⅱ”),原因是_______________
(2)学生乙认为:为了较准确地测量氢气的体积,除了必须检查整个装置的气密性外,在读取反应前后甲管中液面读数的过程中,应注意___________________(填序号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平