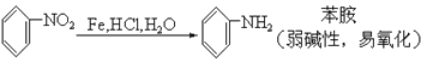
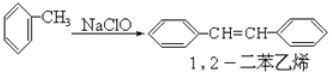
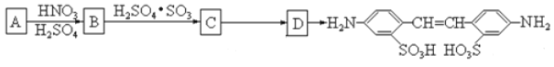
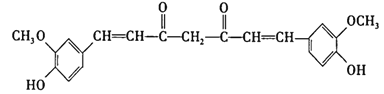
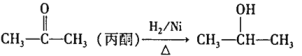题目内容
【题目】雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和HCl的物质的量之比为________。写出化学方程式并用双线桥法标出电子转移_______________________________________________。
(2)上述反应中的氧化剂是________,反应产生的气体可用________吸收。
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O
若生成2 mol H3AsO4,则反应中转移电子的物质的量为________。若将该反应设计成一原电池,则NO2应该在________(填“正极”或“负极”)附近逸出。
【答案】1:2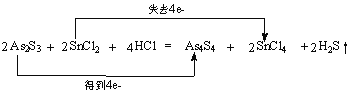 As2S3氢氧化钠溶液或硫酸铜溶液10mol正极
As2S3氢氧化钠溶液或硫酸铜溶液10mol正极
【解析】
(1)根据反应物和生成物:As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,可以得出化学方程式为:2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑,故As2S3和HCl的物质的量之比为1:2;根据电子得失守恒知2molAs2S3作氧化剂得到4mol电子,而2molSnCl2作还原剂失去4mol电子,用双线桥法标出电子转移为 ;(2)反应中As元素化合价降低,As2S3为氧化剂,反应产生的气体H2S为酸性气体,可用氢氧化钠溶液或硫酸铜溶液吸收;(3)由反应As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O可知,As2S3作还原剂,转移电子数为2×(5-3)+3×(0+2)=10,则生成2molH3AsO4时反应中转移电子的物质的量为10mol,又原电池中正极发生还原反应,则某元素的化合价降低,由反应可知N元素的化合价由+5降低到+4,则NO2属于还原产物,在正极生成。
;(2)反应中As元素化合价降低,As2S3为氧化剂,反应产生的气体H2S为酸性气体,可用氢氧化钠溶液或硫酸铜溶液吸收;(3)由反应As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O可知,As2S3作还原剂,转移电子数为2×(5-3)+3×(0+2)=10,则生成2molH3AsO4时反应中转移电子的物质的量为10mol,又原电池中正极发生还原反应,则某元素的化合价降低,由反应可知N元素的化合价由+5降低到+4,则NO2属于还原产物,在正极生成。