题目内容
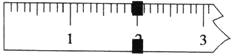
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )(已知:pH=-lgc(H+))

A.将稀醋酸加水稀释时,c(H+)减小,c(OH-)也减小
B.a、b、c三点溶液的pH:b<a<c
C.a、b、c三点CH3COOH的电离程度:c<a<b
D.a、b、c三点溶液用1 mol·L-1NaOH溶液中和,消耗NaOH溶液体积:c<a<b
【答案】B
【解析】
A.醋酸在溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,将稀醋酸加水稀释时,若平衡不移动,溶液中c(CH3COOH)、c(CH3COO-)、c(H+)减小,加水稀释,平衡正向移动,使c(CH3COO-)、c(H+)在减小的基础上又略有增大,但总的来说c(CH3COO-)、c(H+)减小,由于溶液中存在水的电离平衡,Kw= c(H+)·c(OH-)是定值,所以c(H+)减小,则c(OH-)增大,A错误;
CH3COO-+H+,将稀醋酸加水稀释时,若平衡不移动,溶液中c(CH3COOH)、c(CH3COO-)、c(H+)减小,加水稀释,平衡正向移动,使c(CH3COO-)、c(H+)在减小的基础上又略有增大,但总的来说c(CH3COO-)、c(H+)减小,由于溶液中存在水的电离平衡,Kw= c(H+)·c(OH-)是定值,所以c(H+)减小,则c(OH-)增大,A错误;
B.导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,则a、b、c三点溶液的pH为b<a<c,B正确;
C.随水的增多,醋酸的电离的分子数增加,由于醋酸分子总分子数不变,所以醋酸的电离程度在增大,所以a、b、c三点醋酸的电离程度:a<b<c,C错误;
D.a、b、c三点溶液浓度不同,但其中含有溶质的物质的量相同,所以a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积相等,即:a=b=c,D错误;
故合理选项是B。

【题目】炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
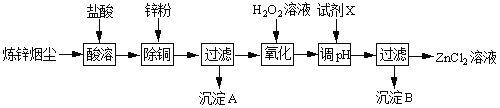
下表列出相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1.1 | 5.2 | 5.8 |
沉淀完全的pH | 3.2 | 6.4 | 8.8 |
(1)加入H2O2溶液的作用是___。
(2)流程图中,调节pH时,加入的试剂X可以是______(填序号),pH应调整到___。
A.ZnO B.NaOH C.Zn2(OH)2CO3 D.ZnSO4
【题目】乙苯是主要的化工产品。某课题组拟制备乙苯:查阅资料如下:
①几种有机物的沸点如下表:
有机物 | 苯 | 溴乙烷 | 乙苯 |
沸点/℃ | 80 | 38.4 | 136.2 |
②化学原理: ![]() +CH3CH2Br
+CH3CH2Br![]()
![]() +HBr。
+HBr。
③氯化铝易升华、易潮解。
I.制备氯化铝
甲同学选择下列装置制备氯化铝(装置不可重复使用):

(1)本实验制备氯气的发生装置的玻璃仪器有________种。
(2)连接装置之后,检查装置的气密性,装药品。先点燃A处酒精灯,当___________ 时(填实验现象)点燃F处酒精灯。
(3)气体流动方向是从左至右,装置导管接口连接顺序a→______→k→i→f→g→_____。
(4)D装置存在明显缺陷,若不改进,导致的实验后果是______________。
II.制备乙苯

乙同学设计实验步骤如下:
步骤1:连接装置并检查气密性(如图所示,夹持装置省略)。
步骤2:用酒精灯微热烧瓶。
步骤3:在烧瓶中加入少量无水氯化铝、适量的苯和溴乙烷。
步骤4:加热,充分反应半小时。
步骤5:提纯产品。
回答下列问题:
(5)本实验加热方式宜采用_______ (填“酒精灯直接加热”或“水浴加热”)。
(6)确认本实验A中已发生了反应的试剂可以是___。
A 硝酸银溶液 B 石蕊试液
C 品红溶液 D 氢氧化钠溶液
(7)提纯产品的操作步骤有:
①过滤; ②用稀盐酸洗涤; ③少量蒸馏水水洗 ④加入大量无水氯化钙;⑤用大量水洗; ⑥蒸馏并收集136.2℃馏分 ⑦分液。
操作的先后顺序为⑤⑦__ __⑦__ __⑥(填其它代号)。