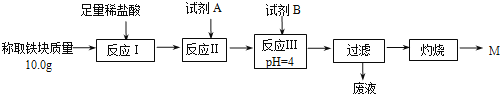
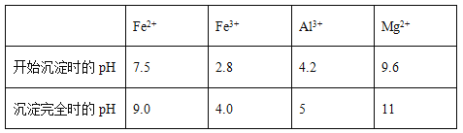
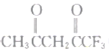题目内容
【题目】表示下列过程的方程式正确的是
A.氨水中一水合氨的电离方程式: NH3·H2O =![]() +OH-
+OH-
B.用浓HNO3溶解铜的离子方程式: 3Cu+2![]() + 8H+==3Cu2+ + 2NO↑+ 4H2O
+ 8H+==3Cu2+ + 2NO↑+ 4H2O
C.苯和硝酸反应的化学方程式:![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
D.钢铁发生电化学腐蚀时负极的电极反应式: Fe-3e- = Fe3+
【答案】C
【解析】
A.一水合氨为弱电解质,在水溶液中部分电离,电离方程式应为NH3·H2O![]()
![]() +OH-,A错误;
+OH-,A错误;
B.浓硝酸与铜反应生成二氧化氮,离子方程式为Cu+2![]() + 4H+==Cu2+ + 2NO2↑+ 2H2O,B错误;
+ 4H+==Cu2+ + 2NO2↑+ 2H2O,B错误;
C.苯与硝酸发生取代反应生成硝基苯和水,C正确;
D.钢铁发生电化学腐蚀时铁失电子生成亚铁离子,负极的电极反应式为Fe-2e- = Fe2+,D错误;
答案选C。

练习册系列答案
相关题目