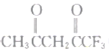题目内容
【题目】将无机碳转化为有机化合物是目前研究的热点,也是减少CO2和CO的有效措施之一,对环境的保护起到了积极作用。
I.二氧化碳催化加氢甲烷化工艺是利用氨还原CO2,反应为CO2(g)+4H2(g)![]() CH4(g)+2H2O(l)H1。
CH4(g)+2H2O(l)H1。
(1)已知:H2(g)的燃烧热H2=-285.8kJ·mol-1,CH4(g)的燃烧热H=-890.3kJ·mol-1,则△H1=________kJ·mol-1。
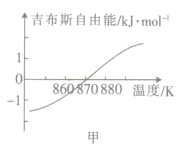
(2)测得该反应的吉布斯自由能(G=H-TS)随温度的变化曲线如图甲所示,为使CO2顺利转化为CH4,反应应在___下进行。
II.一氧化碳催化加氢制甲醇:CO(g)+2H2(g)![]() CH2OH(g)。
CH2OH(g)。
(3)图乙是反应中部分物质的浓度随时间t的变化情况,0~10min内,用H2表示的平均反应速率v(H2)=_____,该反应平衡常数的表达式为_______________。
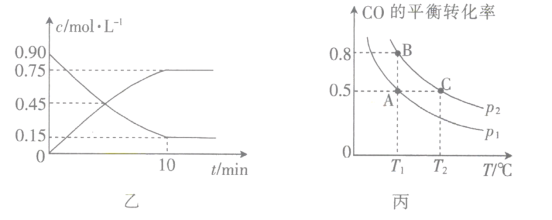
(4)在容积可变的密闭容器中充入10molCO和20molH2,CO的平衡转化率随温度(T)、压强(p)的变化如图丙所示。
①p1______(填“>”“<”或“=”)p2。
②比较图丙中A、C两点,平衡常数KA__________(填“>”“<”或“=")KC。
③若达到化学平衡状态点A时,容器的体积为20L,T1℃时平衡常数KA=______
【答案】-252.9 温度低于870K 0.15mol·L-1·min-1 ![]() < > 4
< > 4
【解析】
(1)H2(g)的燃烧热H2=-285.8kJ·mol-1,则有H2(g)+![]() O2(g)=H2O(l)H2=-285.8kJmol-1 反应a;
O2(g)=H2O(l)H2=-285.8kJmol-1 反应a;
CH4(g)的燃烧热H=-890.3kJ·mol-1,则有CH4(g)+2O2(g)═CO2(g)+2H2O(l)H=-890.3KJmol-1 反应b;
根据盖斯定律:a×4-b可得CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) H1=(-285.8kJmol-1)×4-(-890.3KJmol-1)=-252.9 kJmol-1;
CH4(g)+2H2O(l) H1=(-285.8kJmol-1)×4-(-890.3KJmol-1)=-252.9 kJmol-1;
(2)G<0时反应才有自发性,据图可知温度低于870K时G<0;
(3)据图可知图示两种物质单位时间内浓度变化量相等,根据方程式可知应为CO和CH3OH的物质的量浓度变化曲线,10min内CO或CH3OH的浓度变化均为0.75mol/L,则c(H2)=1.5mol/L,所以v(H2)=![]() =0.15mol·L-1·min-1;根据平衡常数的定义可知该反应的平衡常数表达式为K=
=0.15mol·L-1·min-1;根据平衡常数的定义可知该反应的平衡常数表达式为K=![]() ;
;
(4)①据图可知相同温度下p2压强下CO的转化率更大,该反应为气体体积减小的反应,压强越大转化率越大,所以p1<p2;
②等压条件下温度越高CO的转化率越小,说明温度升高平衡逆向移动,正反应为放热反应,温度越高平衡常数越小,所以KA>KC;
③A点CO的转化率为50%,初始投料为10molCO和20molH2,容器体积为20L,列三段式有:

平衡常数KA=![]() =4。
=4。

【题目】下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 除去NaHCO3固体中混有的NH4HCO3 | 直接将固体加热 |
B | 实验室收集NO2气体 | 用排水集气法收集 |
C | 检验非金属性Cl>C | 在Na2CO3溶液中加入足量HCl |
D | 检验某溶液中是否有 | 取该溶液于试管中,加入NaOH溶液后加热,用湿润的红色石蕊试纸检验 |
A.AB.BC.CD.D