题目内容
13.下列离子方程式不能解释对应实验事实的是( )| A. | 向小苏打溶液滴加少量盐酸:HCO3-+H+═+H2O+CO2↑ | |
| B. | 用漂白液吸收过量SO2:SO2+H2O+ClO-=2H++SO42-+Cl- | |
| C. | 将少量乙烯气体通入酸性KMnO4溶液:CH2=CH2+4H++MnO4-═C2O42-+Mn2++4H2O | |
| D. | 将铜丝插入稀硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
分析 A.小苏打溶液滴加少量盐酸反应生成氯化钠、水和二氧化碳;
B.用漂白液吸收过量SO2,反应生成盐酸和硫酸;
C.乙烯与酸性高锰酸钾发生氧化反应生成二氧化碳;
D.铜与稀硝酸反应生成硝酸铜、一氧化氮和水.
解答 解:A.小苏打溶液滴加少量盐酸反应生成氯化钠、水和二氧化碳,离子方程式:HCO3-+H+═+H2O+CO2↑,故A正确;
B.用漂白液吸收过量SO2,反应生成盐酸和硫酸:SO2+H2O+ClO-=2H++SO42-+Cl-,故B正确;
C.将少量乙烯气体通入酸性KMnO4溶液,离子方程式:5CH2=CH2 +12MnO4n4-+36H+=28H2O+12Mn2++10CO2↑,故C错误;
D.铜丝插入稀硝酸中,反应离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故D正确;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子方程式的书写必须遵循客观规律,遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
相关题目
4.下列说法不正确的是( )
| A. | 大部分金属的冶炼都是通过高温下发生的氧化还原反应实现的 | |
| B. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| C. | 铝及其合金使用广泛,是因为铝比铁更耐酸、碱的腐蚀 | |
| D. | 通常所说的三大合成材料是指塑料、合成橡胶和合成纤维 |
1. 小明对妈妈杀鱼时从鱼肚内取出的鳔产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占$\frac{1}{4}$,其余主要是二氧化碳(二氧化碳易溶于水)和氮气.探究分两步进行.
小明对妈妈杀鱼时从鱼肚内取出的鳔产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占$\frac{1}{4}$,其余主要是二氧化碳(二氧化碳易溶于水)和氮气.探究分两步进行.
(1)测量鳔内气体体积.小明设计了两种方法:
A.用医用注射器抽取鳔内气体,测量其体积;
B.在水下剌破鳔,用排水集气法收集鳔内气体并测量其体积(如图).
你认为两种方法中合理的A.
(2)探究鳔内气体的成分.给你两集气瓶的鳔内气体,请你帮助他设计实验验证假设.
 小明对妈妈杀鱼时从鱼肚内取出的鳔产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占$\frac{1}{4}$,其余主要是二氧化碳(二氧化碳易溶于水)和氮气.探究分两步进行.
小明对妈妈杀鱼时从鱼肚内取出的鳔产生了兴趣,他确定了“探究鳔内气体体积和成分”作为研究性学习的课题.小明通过查阅有关资料获知:这种鱼鳔内氧气约占$\frac{1}{4}$,其余主要是二氧化碳(二氧化碳易溶于水)和氮气.探究分两步进行.(1)测量鳔内气体体积.小明设计了两种方法:
A.用医用注射器抽取鳔内气体,测量其体积;
B.在水下剌破鳔,用排水集气法收集鳔内气体并测量其体积(如图).
你认为两种方法中合理的A.
(2)探究鳔内气体的成分.给你两集气瓶的鳔内气体,请你帮助他设计实验验证假设.
| 验证 | 方 法 | 现 象 |
| 含氧气 | 将燃着的木条放入含有鱼鳔内气体的集气瓶中 | 木条能继续燃烧 |
| 含二氧化碳 | 在含有鱼鳔内气体的集气瓶中加入少量的澄清石灰水 | 石灰水变浑浊 |
18.下列分子中的所有碳原子不可能处在同一平面上的是( )
① ②
② ③
③ ④
④ ⑤
⑤
①
 ②
② ③
③ ④
④ ⑤
⑤
| A. | ①⑤ | B. | ①④ | C. | ②④ | D. | ②③ |
2.能够充分说明在恒温下的密闭容器中,反应 2SO2+O2?2SO3 已经达到平衡状态的标志是( )
| A. | 容器中SO2、O2和SO3共存 | |
| B. | SO2和SO3的物质的量浓度相等 | |
| C. | 容器中SO2、O2、SO3的物质的量之比为2:1:2 | |
| D. | 反应器内压强不再随时间发生变化 |
3.化学与科学、技术、社会、环境密切相关.下列说法不正确的是( )
| A. | 锂可用于制造质量轻、电容量大的可充电电池 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 太阳能电池板中有高纯硅单质,光导纤维的主要成分是二氧化硅 |
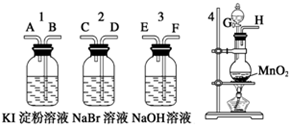 为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2,并将Cl2依次通入NaBr溶液和淀粉KI溶液中.有如图所示的仪器(橡胶塞均为双孔)及药品,试回答:
为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2,并将Cl2依次通入NaBr溶液和淀粉KI溶液中.有如图所示的仪器(橡胶塞均为双孔)及药品,试回答: .
.