题目内容
7.常温下用aL pH=3的醋酸与bLpH=11的氢氧化钠溶液混合得到溶液,下列叙述正确的是( )| A. | 若两种恰好中和,则一定是a=b | B. | 若混合液显碱性,则一定是b≥a | ||
| C. | 若混合液显中性,则可能有a>b | D. | 若混合液显酸性,则可能有a≤b |
分析 常温下,pH=3的醋酸溶液中c(H+)等于pH=11的NaOH溶液中c(OH-),醋酸是弱电解质、NaOH是强电解质,所以醋酸浓度远远大于NaOH,醋酸是一元酸、NaOH是一元碱.
A.如果两种溶液恰好中和,浓度越大的需要体积越小;
B.若混合液显碱性,溶液中的溶质为醋酸钠,或醋酸钠和NaOH或醋酸钠和少量醋酸;
C.如果a=b,醋酸的物质的量远远大于醋酸钠,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,a>b时溶液呈酸性;
D.若混合液显酸性,溶液中的溶质为醋酸钠、醋酸,由于醋酸的电离程度很小,可能存在a≤b.
解答 解:常温下,pH=3的醋酸溶液中c(H+)等于pH=11的NaOH溶液中c(OH-),醋酸是弱电解质、NaOH是强电解质,所以醋酸浓度远远大于NaOH,醋酸是一元酸、NaOH是一元碱,
A.如果两种溶液恰好中和,浓度越大的需要体积越小,所以体积a<b,故A错误;
B.若混合液显碱性,溶液中的溶质为醋酸钠、醋酸钠和NaOH或醋酸钠和少量醋酸,所以溶液体积三种情况都有可能,故B错误;
C.如果a=b,醋酸的物质的量远远大于醋酸钠,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,所以a>b时溶液呈酸性,故C错误;
D.如果a=b,醋酸的物质的量大于NaOH,溶液中溶质为醋酸和醋酸钠,如果醋酸电离程度大于醋酸根离子,则溶液呈酸性;如果a<b,如果二者的物质的量相等或醋酸物质的量小于NaOH,溶液中溶质为醋酸钠或醋酸钠和NaOH,则溶液呈碱性,故D正确;
故选D.
点评 本题考查探究溶液酸碱性,为高考高频点,明确溶液中的溶质及其性质是解本题关键,注意CD采用逆推法分析解答较简便,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.若X+酸?盐+水,则X不可能属于( )
| A. | 氧化物 | B. | 单质 | C. | 碱 | D. | 电解质 |
18.下列物质中,属于非电解质的是( )
| A. | 蔗糖 | B. | 金属镁 | C. | 氧气 | D. | 氧化钠 |
15.将13.2g可能混有下列物质的(NH4)2SO4样品,在加热的条件下,与过量的NaOH反应,可收集到4.3L NH3(标准状况),则样品中不可能含有的物质是( )
| A. | NH4HCO3、NH4NO3 | B. | (NH4)2CO3、NH4NO3 | C. | NH4HCO3、NH4Cl | D. | NH4Cl、(NH4)2CO3 |
3.下列各组离子中,在给定条件下能够大量共存的是( )
| A. | 通入足量CO2后的溶液中:Na+、SO32-、CH3COO-、HCO3- | |
| B. | 无色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Fe2+、NO3-、Cl- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、S2-、SO42- |


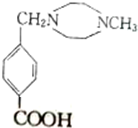 .
.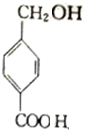 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$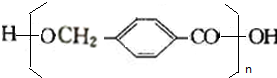 +(n-1)H2O
+(n-1)H2O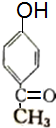 +2Br2→
+2Br2→ +2HBr.
+2HBr.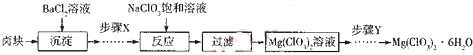
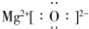 .
.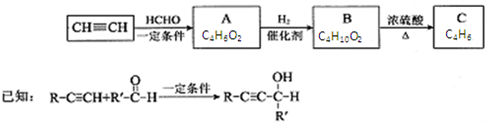
 ,其反应类型消去反应.
,其反应类型消去反应.