题目内容
【题目】如图所示装置可构成原电池。试回答下列问题:
(1)电解质溶液为浓硝酸时,灯泡 (填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的反应为: ;
b.若灯泡不亮,其理由为:
(2)电解质溶液为NaOH溶液时,灯泡 (填“亮”或“不亮”, 填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极反应式为: ;Al电极反应式为: 。
b.若灯泡不亮,其理由为: 。
(3)(Ⅰ)有一种节能的氯碱工业新工艺,将电解池与燃料电池相组合,相关流程如图所示(电极未标出):
回答下列有关问题:
原电池的负极反应式为。
(4)a、b、c的大小关系为:。
【答案】
(1)亮;Mg-2e-=Mg2+;a Al与浓硝酸发生钝化
(2)亮;6H2O+6e-=3H2+6OH-;2Al-6e-+2OH-=2AlO2+6H2O;电解质溶液不合适(答案不唯一)
(3)H2-2e-+2OH-=2H2O
(4)c%>a%>b%
【解析】(1)Mg、Al和浓硝酸构成原电池,有电流通过,所以灯泡会亮
a Al与浓硝酸发生钝化,为正极,而Mg易失电子作负极;Mg电极上发生的电极反应为 Mg-2e-=Mg2+;
(2)该装置中,铝能和氢氧化钠溶液发生氧化还原反应,该装置符合原电池构成条件,所以Mg、Al和NaOH溶液构成原电池,则灯泡亮;
a.Mg作正极,正极上水得电子生成氢气,正极的电极反应为:6H2O+6e-=3H2+6OH- , Al易失电子作负极,负极上电极反应式为2Al-6e-+2OH-=2AlO2+6H2O;
(3)燃料电池中,通入空气的电极是正极,通燃料氢气的电极是负极,其电极反应式为H2-2e-+2OH-=2H2O;(4)燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH- , 所以反应后氢氧化钠的浓度升高,即a%大于b%,负极氢气失电子生成氢离子消耗氢氧根离子,所以c%>a%,得到c%>a%>b%。
根据镁铝在浓硝酸和氢氧化钠溶液中发生不同的反应进行判断原电池的正负极,然后进行分析电极反应等即可。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,在CO2中通入H2,二者可发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·mol-1
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
某实验室控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
反应序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
① | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
② | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
③ | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
④ | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
(1)CO2的电子式是_____________。
(2)反应Ⅰ的平衡常数表达式是K=______。
(3)对比①和③可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因_______________;
对比①、②可发现,在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因____________。
(4)有利于提高CO2转化为CH3OH平衡转化率的措施有____。
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.低反应温度
d.投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
【题目】碘及其化合物在生产、生活中具有重要作用。请按要求回答下列问题:
(1)海带灰浸取液中的碘元素以I-形式存在。现利用如下试剂:MnO2、稀硫酸、淀粉溶液,从中获取单质碘。请按要求完善下表:
序号 | 所选试剂 | 反应原理或现象或解释 |
方法1 | MnO2、稀硫酸 | 离子方程式:________ |
方法2 | 稀硫酸、淀粉溶液 | 溶液变蓝的原因。用离子方程式解释: ____________ |
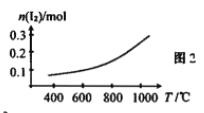
(2)反应2HI(g) ![]() H2(g)+I2(g)的能量变化如图1所示:其他条件相同,1molHI在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示。
H2(g)+I2(g)的能量变化如图1所示:其他条件相同,1molHI在不同温度分解达平衡时,测得体系中n(I2)随温度变化的曲线如图2所示。
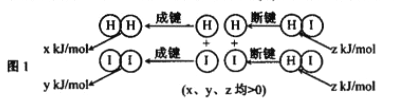
①比较2z______(x+y)(填 “<"、“>”或“=”).
②某温度下该反应的平衡常数K=1/9,达平衡时,HI的转化率=___________。
③只改变该反应的一个条件,试写出能提高HI转化率的两项措施:__________、_________。
(3)已知:i.分解1molH2O2放出热量98kJ;ⅱ.含少量I-的溶液中,H2O2的分解机为: H2O2+I-![]() H2O+IO-慢;H2O2+IO-
H2O+IO-慢;H2O2+IO-![]() H2O+O2+I-快。ⅲ.H2O2分解速率受多种因素影响,实验测得某温度时不同条件下H2O浓度随时间的变化如图3、4所示:
H2O+O2+I-快。ⅲ.H2O2分解速率受多种因素影响,实验测得某温度时不同条件下H2O浓度随时间的变化如图3、4所示:

请完善由以上信息可得到的如下结论:
①H2O2分解反应的热化学方程式为___________。
②H2O2的分解速率与_________有关。
③“少量Mn2+存在时,溶液碱性越强H2O2分解速率越大”的结论是否正确_______(填“是"或“否”);c(Mn2+)对H2O分解速率的影响是__________。
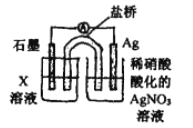
【题目】某实验小组同学在探究Fe、Fe3+、Ag+相互间的反应时,设计了如下系列实验。已知: Ag+与SCN- 生成白色沉淀AgSCN。请按要求回答下列问题。
他们先向硝酸酸化的0.05mol/L AgNO3溶液(pH≈2) 中加入稍过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色; 经检验未生成其他含氮物质.
(1)由“黑色固体”,甲猜测固体中含有Ag; 他取出少量黑色固体,洗涤后放入试管中,后续操作是_______,发现有白色沉淀产生。
(2)乙取上层清液于试管中,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀。由此得出Fe与Ag+间发生的离子反应之一为___________。
(3)由“溶液呈黄色”,丙猜测溶液中有Fe3+; 而丁认为在铁粉稍过量充分反应后的溶液中不可能合有Fe3+,其理由是(用离子方程式表示):________。
丙为证实自己的猜测,取上层清液,滴加_______,溶液变红,同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
①“白色沉淀”是_________。
②丙对Fe3+产生的原因分析:
因“未生成其他含氮物质”,故认为Fe2+不是被________氧化的。随后又提出了如下假设:
假设a:可能是铁粉表面有氧化层,与H+反应生成Fe3+;
假设b:Fe2+被O2氧化,而产生Fe3+;其对应的高子反应方程式为_________
假设c:__________氧化了Fe2+,而产生Fe3+
③丙为证实假设a、b不是主要原因,又补充了对比实验: 向硝酸酸化的(pH=2)_____中加入过量铁粉,搅拌后静置,不同时间取上层清液清加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色。
④戊为证实上述假设c成立,设计了如右图所示装置:分别取此电池工作前与工作-段时间电源计指针回至“0”时左池中的溶液,同时分别滴加K3[FeCN)6]溶液,后者蓝色沉淀较少;左池再滴加X的浓溶液,指针又有偏转。则X为________溶液;该电池总反应的离子方程式为:__________。