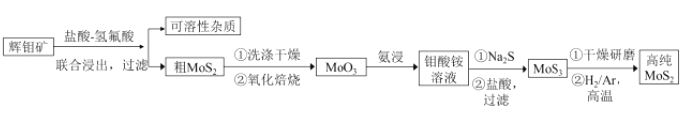
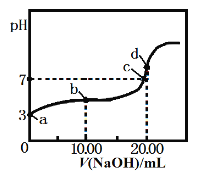
题目内容
【题目】某实验小组同学在探究Fe、Fe3+、Ag+相互间的反应时,设计了如下系列实验。已知: Ag+与SCN- 生成白色沉淀AgSCN。请按要求回答下列问题。
他们先向硝酸酸化的0.05mol/L AgNO3溶液(pH≈2) 中加入稍过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色; 经检验未生成其他含氮物质.
(1)由“黑色固体”,甲猜测固体中含有Ag; 他取出少量黑色固体,洗涤后放入试管中,后续操作是_______,发现有白色沉淀产生。
(2)乙取上层清液于试管中,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀。由此得出Fe与Ag+间发生的离子反应之一为___________。
(3)由“溶液呈黄色”,丙猜测溶液中有Fe3+; 而丁认为在铁粉稍过量充分反应后的溶液中不可能合有Fe3+,其理由是(用离子方程式表示):________。
丙为证实自己的猜测,取上层清液,滴加_______,溶液变红,同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
①“白色沉淀”是_________。
②丙对Fe3+产生的原因分析:
因“未生成其他含氮物质”,故认为Fe2+不是被________氧化的。随后又提出了如下假设:
假设a:可能是铁粉表面有氧化层,与H+反应生成Fe3+;
假设b:Fe2+被O2氧化,而产生Fe3+;其对应的高子反应方程式为_________
假设c:__________氧化了Fe2+,而产生Fe3+
③丙为证实假设a、b不是主要原因,又补充了对比实验: 向硝酸酸化的(pH=2)_____中加入过量铁粉,搅拌后静置,不同时间取上层清液清加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色。
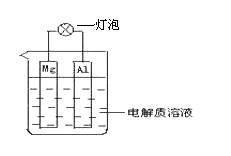
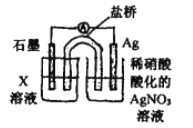
④戊为证实上述假设c成立,设计了如右图所示装置:分别取此电池工作前与工作-段时间电源计指针回至“0”时左池中的溶液,同时分别滴加K3[FeCN)6]溶液,后者蓝色沉淀较少;左池再滴加X的浓溶液,指针又有偏转。则X为________溶液;该电池总反应的离子方程式为:__________。
【答案】 加硝酸,微热,溶解固体,再滴加稀盐酸 Fe+2Ag+=Fe2++2Ag Fe+2Fe3+=3Fe2+ KSCN溶液 AgSCN 酸性溶液(pH≈2)中NO3- Fe2++O2+4H+=4Fe3++2H2O Ag+ 0.05mol/LNaNO3溶液 FeCl2溶液或FeSO4溶液 Fe2++Ag+![]() Fe3++Ag
Fe3++Ag
【解析】(1)银与足量硝酸反应生成硝酸银溶液,再滴加盐酸,有白色沉淀氯化银产生;正确答案:加硝酸,微热,溶解固体,再滴加稀盐酸;
(2)滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,溶液中含有Fe2+;Fe与Ag+间发生置换反应生成银;正确答案:Fe+2Ag+=Fe2++2Ag;
(3)铁与铁离子可以发生归中反应,生成Fe2+;正确答案:Fe+2Fe3+=3Fe2+;铁离子与硫氰化钾溶液相遇,溶液变红;白色沉淀为可能为银离子与硫氰根离子生成了硫氰化银白色沉淀;①正确答案:AgSCN;②因“未生成其他含氮物质”,也就是说硝酸(或酸性条件下的NO3-)没有氧化Fe2+;有可能Fe2+是被氧气在酸性条件下氧化为Fe3+,正确答案:酸性溶液(pH≈2)中NO3-;Fe2++O2+4H+=4Fe3++2H2O; 溶液中还含有银离子,具有一定的氧化性,有可能银离子氧化亚铁离子;正确答案:银离子;
③满足相同条件下,向硝酸酸化的(pH=2) 0.05mol/L硝酸钠溶液中加入过量铁粉,铁先被硝酸氧化为铁离子,取上层清液清加KSCN溶液,3min时溶液呈浅红色,然后生成的铁离子又被过量的铁还原为亚铁离子,30min后溶液几乎无色。正确答案:0.05mol/L硝酸钠溶液;
④根据题给信息,左池蓝色沉淀较少,说明亚铁离子浓度减少了;再向左池再滴加的FeCl2浓溶液,指针偏转,说明反应向生成铁离子方向进行,证明了银离子氧化亚铁离子:Fe2++Ag+![]() Fe3++Ag;正确答案:FeCl2浓溶液或FeSO4浓溶液;Fe2++Ag+
Fe3++Ag;正确答案:FeCl2浓溶液或FeSO4浓溶液;Fe2++Ag+![]() Fe3++Ag;
Fe3++Ag;

 名校课堂系列答案
名校课堂系列答案【题目】实验室按照图1所示装置制备氯酸钾、氯水并进行有关探究实验。
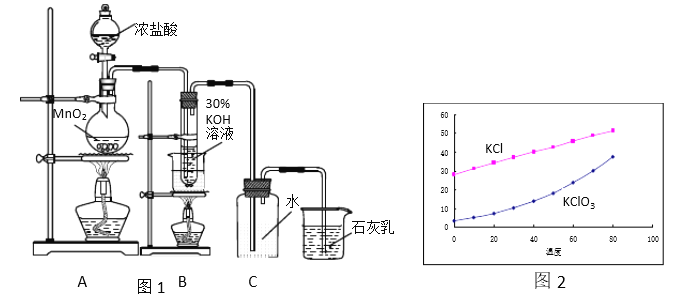
Ⅰ实验一 制取氯酸钾和氯水
(1)A中发生反应的化学方程式是_____________。
(2)制备KClO3需在70℃~80℃进行,写出制备KClO3的离子方程式______。
(3)装置C的作用是_____ 。
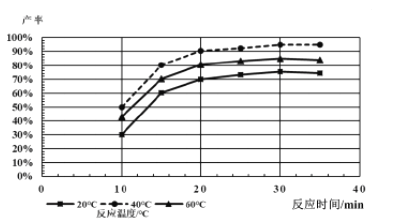
(4)KCl 和KClO3的溶解度如图2所示。反应结束后,将装置B中的溶液放到冰水浴中, 20秒后会析出较多晶体X。这样做是因为________(选填a、b、c):
a. KClO3溶解度受温度影响较大而KCl溶解度受温度影响较小
b. 0℃时,KClO3溶解度比KCl小
c. 溶液中的溶质主要是KClO3
所以在冷却过程中晶体X会沉淀析出,X的化学式是_______。
(5)上一步操作会不可避免地使另一种物质同时析出,因此要获得较纯净的X,需要进行的具体的操作步骤是_________________。
Ⅱ实验二 氯酸钾性质研究
(6)在不同条件下KClO3可将KI氧化为不同的产物。该小组设计了如下实验,研究反应条件对反应产物的影响(实验在室温下进行):
0.20 mol·L KI/ mL | KClO3(s) /g | 6.0 mol·L-1 H2SO4/ mL | 蒸馏水/ mL | |
试管1 | 1.0 | 0.10 | 0 | 9.0 |
试管2 | 1.0 | 0.10 | 3.0 | 6.0 |
①该实验的实验目的是__。
②设计试管1实验的作用是_____。
③实验后发现,试管2中产生黄色溶液,该同学预测KI被氧化为I2。用离子方程式表示该同学的预测____________;请设计2种实验方案验证该预测正确(从加入试剂、现象、结论等方面描述)______________。
【题目】下表物质与其所含化学键类型、所属化合物类型不正确的一组是( )
选 项 | A | B | C | D |
物 质 | Na2O2 | H2O | HCl | NaCl |
所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键 |
所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 离子化合物 |
A.A
B.B
C.C
D.D