题目内容
11.请写出合成下列高分子化合物的单体的结构简式.(1)
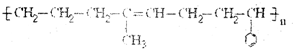 ;
;(2)
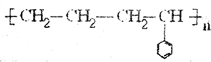 .
.
分析 由于单体经过某些化学反应(如加聚、缩聚、开环等)生成高聚物,所以在高分子链中,单体转变为在化学组成上能够重复的最小单位,即链节.判断高聚物的单体,就是根据高分子链,结合单体间可能发生的反应机理,找出高分子链中的链节,判断其单体.
①凡链节主链只有两个碳原子(无其他原子)的聚合物,其合成单体必为一种,将两个半键闭合即可.
②凡链节主链有四个碳原子(无其他原子),且链节无双键的聚合物,其单体必为两种,在中央画线断开,然后两键闭合即可.
③凡链节主链上只有碳原子,仅存在碳碳双键结构的高聚物,其规律是“凡双键,四个碳;无双键,两个碳”画线断开.
解答 解:(1)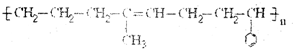 的单体是:CH2=CH2;
的单体是:CH2=CH2;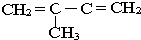 ;
; ,故答案为:CH2=CH2;
,故答案为:CH2=CH2;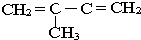 ;
; ;
;
(2)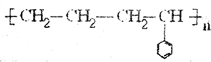 的单体是CH2=CH2;
的单体是CH2=CH2; ,故答案为:CH2=CH2;
,故答案为:CH2=CH2; .
.
点评 本题考查根据聚合反应产物判断其单体的方法,题目难度中等,解题根据是明确高分子化合物为加聚反应还是缩聚反应产物,然后根据反应特点找出单体即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.已知AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,常温下,在AG=-10的溶液中能大量存在的离子组是( )
| A. | Cl-,AlO2-,SO32-,Na+ | B. | NO3-,CH3COO-,Na+,NH4+ | ||
| C. | Cl-,NO3-,Mg2+,K+ | D. | SO42-,HCO3-,Cl-,K+ |
2.下列各离子浓度的大小比较,正确的是( )
| A. | 同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl,④NH3•H2O,c(NH4+)由大到小的顺序是:①>③>②>④ | |
| B. | 常温时,将等体积的盐酸和氨水混合后pH=7,则c (NH4+)>c (Cl-) | |
| C. | 0.2 mol•L-1Na2CO3溶液中:c (CO32-)+c (HCO3-)+c (H2CO3)=0.2 mol•L-1 | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到酸性溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
19.0.25mol Ca(OH)2跟0.3mol H3PO4在一定条件下充分反应,得到CaHPO4和Ca(H2PO4)2,则这两种产物的物质的量之比为( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 4:1 |
6.下列使用漏斗的几个实验装置中,设计正确且能达到实验目的是( )


| A. | 用图甲所示装置制取并收集少量的N02气体(不考虑倒吸) | |
| B. | 用图乙所示装置制取并收集氨气 | |
| C. | 用图丙所示装置用苯萃取碘水中的碘,并将碘的苯溶液从漏斗下口放出 | |
| D. | 用图丁所示装置配制一定物质的量浓度的溶液 |
1.有关pH计算结果一定正确的是 ( )
①强酸pH=a,加水稀释到10n倍,则pH=a+n;
②弱酸pH=a,加水稀释到10n倍,则pH<a+n(a+n<7);
③强碱pH=b,加水稀释到10n倍,则pH=b-n;
④弱碱pH=b,加水稀释到10n倍,则pH>b-n(b-n>7).
①强酸pH=a,加水稀释到10n倍,则pH=a+n;
②弱酸pH=a,加水稀释到10n倍,则pH<a+n(a+n<7);
③强碱pH=b,加水稀释到10n倍,则pH=b-n;
④弱碱pH=b,加水稀释到10n倍,则pH>b-n(b-n>7).
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
1.下列三个化学反应的平衡常数与温度的关系分别如表所示:
请回答:
(1)写出反应③的平衡常数K的表达式$\frac{C(CO{\;}_{2}).C(H{\;}_{2})}{C(CO).C(H{\;}_{2}O)}$.
(2)根据反应①与②推导出Q1、Q2与Q的关系,Q=Q2-Q1(用Q1、Q2表示)根据反应①与②推导出K1、K2与K的关系,则K=$\frac{K{\;}_{2}}{K{\;}_{1}}$(用K1、K2表示).
(3)反应③是放热(填“吸热”或“放热”)反应.
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有bd(填序号).
a.扩大反应容器的容积 b.升高温度
c.使用合适的催化剂 d.增大CO2的浓度
(5)1173K时,若向一容积固定的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和xmol H2,若要使上述反应开始时正向进行,则x应满足的条件是x<2.4.
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=Q1 kJ/mol | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2 kJ/mol | K2 | 2.38 | 1.72 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g)△H=QkJ/mol | K | ? | ? |
(1)写出反应③的平衡常数K的表达式$\frac{C(CO{\;}_{2}).C(H{\;}_{2})}{C(CO).C(H{\;}_{2}O)}$.
(2)根据反应①与②推导出Q1、Q2与Q的关系,Q=Q2-Q1(用Q1、Q2表示)根据反应①与②推导出K1、K2与K的关系,则K=$\frac{K{\;}_{2}}{K{\;}_{1}}$(用K1、K2表示).
(3)反应③是放热(填“吸热”或“放热”)反应.
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有bd(填序号).
a.扩大反应容器的容积 b.升高温度
c.使用合适的催化剂 d.增大CO2的浓度
(5)1173K时,若向一容积固定的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和xmol H2,若要使上述反应开始时正向进行,则x应满足的条件是x<2.4.
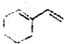 与溴的四氯化碳溶液反应(1:1)的产物的结构简式.
与溴的四氯化碳溶液反应(1:1)的产物的结构简式.