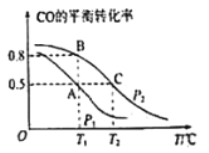
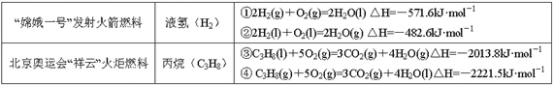题目内容
【题目】硝酸钙晶体[Ca(NO3)2·4H2O]常用于电子、仪表及冶金工业。一种利用CaO制备Ca(NO3)2·4H2O的流程如下:
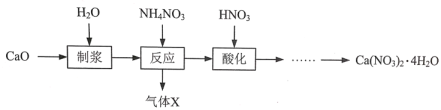
(1)“制浆”过程中发生反应的化学方程式是__。
(2)“气体X”的化学式是___。
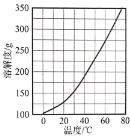
(3)Ca(NO3)2·4H2O的溶解度随温度变化的曲线如图所示。“酸化”后制取Ca(NO3)2·4H2O的操作主要包括加热浓缩、__、过滤、洗涤、干燥。实验室过滤操作必须用到的玻璃仪器有烧杯、玻璃棒和__。
【答案】CaO+H2O=Ca(OH)2 NH3 降温结晶 漏斗
【解析】
(1)依据加入的物质写出化学方程式;
(2)依据氢氧化钙和硝酸铵反应分析产生的气体;
(3)依据过滤的操作选择仪器。
(1)制浆的时候加入的是氧化钙和水,所以化学方程式是CaO+H2O=Ca(OH)2 ,
故答案为:CaO+H2O=Ca(OH)2 。
(2)制浆时生成了Ca(OH)2 ,氢氧化钙与硝酸铵反应生成氨气,故放出的气体是氨气,
故答案为:NH3;
(3)从溶液中获得晶体需要蒸发浓缩,降温结晶,过滤,洗涤,干燥,过滤的时候需要的玻璃仪器有漏斗,烧杯,玻璃棒,
故答案为:降温结晶;漏斗。

练习册系列答案
相关题目