题目内容
【题目】分析下表中的四个热化学方程式,判断氢气和丙烷的标准燃烧热分别是
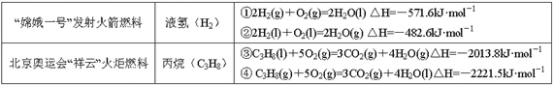
A.-571.6 kJ·mol-1,-2221.5 kJ·mol-1B.-285.5 kJ·mol-1,-2013.8 kJ·mol-1
C.-285.8 kJ·mol-1,-2221.5 kJ·mol-1D.-241.3 kJ·mol-1,-2013.8 kJ·mol-1
【答案】C
【解析】
①2H2(g)+O2(g)=2H2O(l) △H=-571.6kJmol-1,热化学方程式是2mol氢气燃烧生成稳定氧化物的反应放出的热量,而燃烧热为1mol氢气完全燃烧产生稳定的氧化物所放出的热量,是571.6÷2=285.8kJmol-1; ②2H2(l)+O2(l)=2H2O(g) △H=-482.6kJmol-1,热化学方程式生成的是气体水,不是稳定氧化物,不能据此计算;③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g) △H=-2013.8kJmol-1,反应生成的水是气体,不是稳定氧化物,不能据此计算;④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) △H=-2221.5kJmol-1,是1mol丙烷完全燃烧生成稳定氧化物放出的热量,所以丙烷的燃烧热即为2221.5kJmol-1;
故选C。

练习册系列答案
相关题目