题目内容
下列元素性质的递变规律正确的是( )
| A.原子半径:Be<B<C<N |
| B.第一电离能:B<Be<Mg<Na |
| C.元素的电负性:O>N>P>Si |
| D.气态氢化物的稳定性:NH3<CH4<PH3<SiH4 |
C
试题分析:A.Be、B、C、N但是第二周期的元素。原子序数逐渐增大。同一周期的元素,原子序数越大,原子半径就越小。所以原子半径:Be> B>C >N。错误。B.一般情况下,同一周期的元素,原子序数越大,第一电离能就越大。原子序数B >Be。Mg>Na[第一电离能:B>Be;Mg>Na[错误。。C.同一周期的元素,原子序数越大,元素的非金属性就越强,元素的电负性就越大,所以元素的电负性:O>N; P>Si。对于同一主族的元素来说,从上到下,元素的原子半径逐渐增大,元素的非金属性逐渐减弱,四元素的电负性就越小。因此N>P。故元素的电负性:O>N>P>Si。正确。D.元素的非金属性越强,其对应的气态氢化物的稳定性就越强。元素的非金属性N>P>C>Si,所以气态氢化物的稳定性:NH3> PH3>CH4>SiH4。错误。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
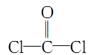 ,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键,其中心原子采取 杂化轨道方式。



