题目内容
A、B、C、D、E五种短周期元素,已知:
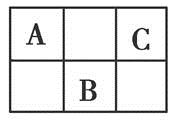
①原子半径递增顺序为:A、D、C、B、E
②短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小
③B、C、D三种元素电子层相同,三者原子序数之和为21,且D原子次外层电子数为最外层电子数的,
请回答下列问题:
(1)写出E单质在D单质中燃烧产物的电子式: 。(2)C2A4·H2O与NH3·H2O相似,水溶液也呈弱碱性,用电离方程式表示其水溶液呈弱碱性的原因: 。(3)B、D、E三种元素可组成常见化合物X,A、B、D、E可组成常见化合物Y,X、Y均是生活中常见的化学试剂,它们在一定条件下可互相转化。当a mol Y转化成amol X时:(溶液中进行)
①若加入a mol纯净物Z就可实现转化,则加入Z为 (填一种Z物质化学式)。②若加入0.5a mol纯净物Z就可实现转化,则加入Z为 (填一种Z物质化学式)。(4)C2A4可用作高能燃料电池的燃料,生成物之一为C的单质,惰性材料作电极,KOH作电解质溶液构成原电池,写出负极的电极反应: ;用该电池电解过量CuSO4溶液,共收集到3.36 L(标准状况)的气体,电池消耗6.4 g C2A4,则该燃料的利用率为 。
①原子半径递增顺序为:A、D、C、B、E
②短周期(除稀有气体元素外)所有元素中A的原子半径与E的原子半径之比为最小
③B、C、D三种元素电子层相同,三者原子序数之和为21,且D原子次外层电子数为最外层电子数的,
请回答下列问题:
(1)写出E单质在D单质中燃烧产物的电子式: 。(2)C2A4·H2O与NH3·H2O相似,水溶液也呈弱碱性,用电离方程式表示其水溶液呈弱碱性的原因: 。(3)B、D、E三种元素可组成常见化合物X,A、B、D、E可组成常见化合物Y,X、Y均是生活中常见的化学试剂,它们在一定条件下可互相转化。当a mol Y转化成amol X时:(溶液中进行)
①若加入a mol纯净物Z就可实现转化,则加入Z为 (填一种Z物质化学式)。②若加入0.5a mol纯净物Z就可实现转化,则加入Z为 (填一种Z物质化学式)。(4)C2A4可用作高能燃料电池的燃料,生成物之一为C的单质,惰性材料作电极,KOH作电解质溶液构成原电池,写出负极的电极反应: ;用该电池电解过量CuSO4溶液,共收集到3.36 L(标准状况)的气体,电池消耗6.4 g C2A4,则该燃料的利用率为 。
(1)Na+[∶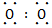 ∶]2-Na+
∶]2-Na+
(2)N2H4·H2O N2
N2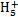 +OH-
+OH-
(3)①NaOH(或其他合理答案) ②Na2O(或其他合理答案)
(4) N2H4-4e-+4OH- N2+4H2O 75%
N2+4H2O 75%
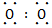 ∶]2-Na+
∶]2-Na+(2)N2H4·H2O
 N2
N2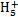 +OH-
+OH-(3)①NaOH(或其他合理答案) ②Na2O(或其他合理答案)
(4) N2H4-4e-+4OH-
 N2+4H2O 75%
N2+4H2O 75%由②可知A是原子半径最小的H,E为短周期元素原子半径最大的Na,由③可知D为O,结合①可知B、C、D在元素周期表中的大致位置为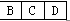 ;由原子序数之和为21可知B、C只能分别为碳、氮。(1)E与D点燃生成Na2O2,电子式为Na+[∶
;由原子序数之和为21可知B、C只能分别为碳、氮。(1)E与D点燃生成Na2O2,电子式为Na+[∶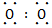 ∶]2-Na+;(2)结合NH3·H2O电离的方程式即可写出N2H4·H2O的电离方程式;(3)NaHCO3转化为Na2CO3应该加入碱,由a mol Y转化成a mol X可知①可能是NaOH或Na;②中1 mol物质溶于水生成2 mol NaOH,可以是Na2O或Na2O2;(4)燃料作负极失电子,N2H4失4个电子生成N2和H2O,碱性溶液中用OH-配平;电解池只生成O2,n(O2)="0.15" mol,转移电子0.6 mol;n(N2H4)="0.2" mol,转移电子0.8 mol,所以燃料利用率为
∶]2-Na+;(2)结合NH3·H2O电离的方程式即可写出N2H4·H2O的电离方程式;(3)NaHCO3转化为Na2CO3应该加入碱,由a mol Y转化成a mol X可知①可能是NaOH或Na;②中1 mol物质溶于水生成2 mol NaOH,可以是Na2O或Na2O2;(4)燃料作负极失电子,N2H4失4个电子生成N2和H2O,碱性溶液中用OH-配平;电解池只生成O2,n(O2)="0.15" mol,转移电子0.6 mol;n(N2H4)="0.2" mol,转移电子0.8 mol,所以燃料利用率为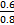 ×100%=75%。
×100%=75%。
 ;由原子序数之和为21可知B、C只能分别为碳、氮。(1)E与D点燃生成Na2O2,电子式为Na+[∶
;由原子序数之和为21可知B、C只能分别为碳、氮。(1)E与D点燃生成Na2O2,电子式为Na+[∶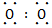 ∶]2-Na+;(2)结合NH3·H2O电离的方程式即可写出N2H4·H2O的电离方程式;(3)NaHCO3转化为Na2CO3应该加入碱,由a mol Y转化成a mol X可知①可能是NaOH或Na;②中1 mol物质溶于水生成2 mol NaOH,可以是Na2O或Na2O2;(4)燃料作负极失电子,N2H4失4个电子生成N2和H2O,碱性溶液中用OH-配平;电解池只生成O2,n(O2)="0.15" mol,转移电子0.6 mol;n(N2H4)="0.2" mol,转移电子0.8 mol,所以燃料利用率为
∶]2-Na+;(2)结合NH3·H2O电离的方程式即可写出N2H4·H2O的电离方程式;(3)NaHCO3转化为Na2CO3应该加入碱,由a mol Y转化成a mol X可知①可能是NaOH或Na;②中1 mol物质溶于水生成2 mol NaOH,可以是Na2O或Na2O2;(4)燃料作负极失电子,N2H4失4个电子生成N2和H2O,碱性溶液中用OH-配平;电解池只生成O2,n(O2)="0.15" mol,转移电子0.6 mol;n(N2H4)="0.2" mol,转移电子0.8 mol,所以燃料利用率为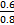 ×100%=75%。
×100%=75%。
练习册系列答案
相关题目