题目内容
常温下体积相同的下列四种溶液:①pH=3的盐酸 ②pH=3的醋酸溶液 ③pH=11的氨水 ④pH=11的NaOH溶液。下列说法中,正确的是
| A.②和④混合,所得混合溶液的pH大于7 |
| B.将四种溶液分别稀释到体积为原的100倍,溶液pH大小顺序③>④>②>① |
| C.③和④分别与足量稀硫酸中和,消耗硫酸的体积③=④ |
| D.①和③混合,所得混合溶液中c(H+)+ c(NH4+)=c(Cl-)+c(OH-) |
D
解析试题分析:②和④混合,因为醋酸为弱酸,醋酸的浓度远远大于0.001mol?L?1,而NaOH为强碱,其浓度为0.001mol?L?1,等体积混合,醋酸过量,混合后pH小于7,故A项错误;醋酸、氨水为弱酸、弱碱,加水稀释能促进电离,故溶液pH大小顺序为③>④>①>②,B项错误;因为氨水浓度大,所以消耗硫酸的体积③>④,故C项错误;①和③混合,氨水过量,溶质为NH4Cl和HCl,含有的离子为:NH4+、Cl?、H+、OH?,根据电荷守恒可得:c(H+)+ c(NH4+)=c(Cl-)+c(OH-),故D项正确。
考点:本题考查离子浓度比较、电离平衡和电荷守恒。

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
下述实验能达到顶期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 向1mL0.2mol/LNaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同条件下,溶解度Mg(OH)2>Fe(OH)3 |
| B | 向混有BaCO3沉淀的NaOH溶液中滴入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中NaOH含量 |
| C | 两种一元碱溶液X和Y(X的pH比Y大l),分别加水稀释l00倍后,pH相等 | 证明稀释前c(X)=10c(Y) |
| D | 测定等物质的量浓度的HF与HCl溶液的pH,后者较小 | 证明非金属性Cl>F |
常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是
| A.KHC2O4溶液呈弱碱性 |
| B.B点时:c(K+)>c(HC2O4-)>c(H+)>c(OH-) |
| C.C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)< c(HC2O4-)+2c(C2O42-)+c(H2C2O4) |
| D.D点时:c(H+)+ c(HC2O4-)+ c(H2C2O4)= c(OH-) |
常温下,体积、物质的量浓度均相等的四种溶液:①盐酸;②醋酸;③氨水;④CH3COONa溶液。下列说法正确的是
| A.将①与②分别稀释相同倍数后溶液的pH:①>② |
| B.③与④中已电离的水分子的数目相等 |
| C.若②与③混合后溶液呈中性,则在常温下Ka(CH3COOH)=Kb(NH3·H2O) |
| D.②与④混合所得溶液显酸性,则:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
下列说法正确的是
| A.常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH+4)>c(Cl-) |
| C.0.lmol ·L-1的氯化铵溶液与0.05mol·L-1的氢氧化钠溶液等体积混合后溶液中离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) |
| D.0.lmol ·L-1硫化钠溶液中离子浓度的关系:c(Na+)=c(S2-)+ c(HS-)+ c(H2S) |
下列叙述正确的是
A.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 |
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中 减小 减小 |
| C.室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立 |
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 ? H2O的电离常数Kb=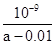 |
在25℃时,将0.2molCH3COONa晶体和0.1molHCl气体同时溶解于同一烧杯的水中,制得1L溶液,若此溶液中c(CH3COO-)>c(Cl-),则下列判断不正确的是
| A.该溶液的pH大于7 |
| B.c(CH3COOH)+c(CH3COO-)=0.20mol·L-1 |
| C.c(CH3COOH)<c(CH3COO-) |
| D.c(CH3COO-)+c(OH-)=0.10mol·L-1 |
下列有关电解质溶液中微粒的关系不正确的是
| A.25℃时,pH=4的氯化铵溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B.25℃时,pH=3的氯化铵溶液中: c(OH-)=1.0×10-11mol·L-1 |
| C.将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 |
| D.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+) = c(SO42-) >c(NH4+) >c(H+) > c(OH-) |