题目内容
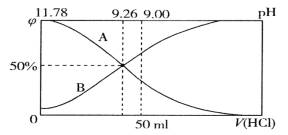
【题目】室温下,向一定体积的0.1mol·L-1的Na2CO3溶液中逐滴加入0.1mol·L-1盐酸至过量,溶液中含碳元素的各微粒的物质的量浓度的百分含量随溶液pH的变化如图所示(CO2因逸出未画出,滴加盐酸的过程中温度的变化忽略不计)。下列说法正确的是
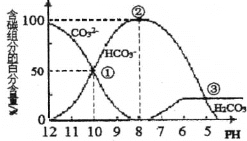
A. 由图可知,碳酸的-lgKa2=10
B. 点②所示溶液中:c(HCO3-)=0.1mol·L-1
C. 当滴加盐酸到点③时,才开始放出CO2气体
D. Na2CO3第一步水解反应的平衡常数:①>②>③
【答案】A
【解析】
A.已知HCO3-![]() CO32-+H+,当pH=10,即c(H+)=10-10mol/L时,c(HCO3-)=c(CO32-),此时Ka2=
CO32-+H+,当pH=10,即c(H+)=10-10mol/L时,c(HCO3-)=c(CO32-),此时Ka2=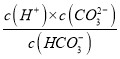 =c(H+)=10-10mol/L,则碳酸的-lgKa2=10,故A正确;
=c(H+)=10-10mol/L,则碳酸的-lgKa2=10,故A正确;
B.点②所示溶液中含C元素的微粒有HCO3-、CO32-,且滴加盐酸后溶液体积增大,物料守恒可知,c(HCO3-)+c(CO32-)<0.1mol/L,故B错误;
C.图象可知PH≤6时,H2CO3的量保持不变,说明PH=6时,二氧化碳在溶液中已达到饱和,之后就会有二氧化碳气体放出,故C错误;
D.平衡常数只随温度变化,温度不变平衡常数不变,Na2CO3第一步水解反应的平衡常数:①=②=③,故D错误;
故答案为A。

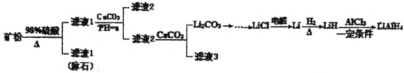
【题目】四氢铝锂(LiAlH4)常作有机合成的重要还原剂。以辉锂矿(主要成分Li2OAl2O34SiO2,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
已知:①几种金属氢氧化物沉淀的pH如表所示:
物质 | Fe(OH)3 | A1(OH)3 |
开始沉淀的pH | 2.3 | 4.0 |
完全沉淀的pH | 3.7 | 6.5 |
②常温下,Ksp(Li2CO3)=2.0×10-3。Li2CO3在水中溶解度随着温度升高而减小。
回答下列问题:
(1)上述流程中,提高“酸浸”速率的措施有____ (写两条);加入CaCO3的作用是____,“a”的最小值为____。
(2)用热水洗涤Li2CO3固体,而不用冷水洗涤,其目的是___;检验碳酸锂是否洗净的实验操作是___。
(3)写出LiH和AlCl3反应的化学方程式:___(条件不作要求)
(4)设计简单方案由Li2CO3制备无水LiCl:___。
(5)在有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢气的还原能力,LiAlH4的“有效氢"为___。(结果保留2位小数)