题目内容
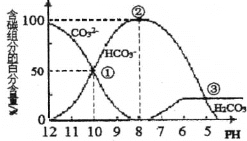
【题目】常温下向100mL 0.2mol·L-1的氨水中逐滴加入0.2mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数![]() 与加入盐酸的体积V的关系如图所示,下列说法错误的是
与加入盐酸的体积V的关系如图所示,下列说法错误的是
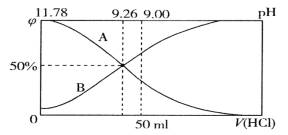
A. 表示NH3·H2O物质的量分数变化的曲线是A
B. NH3·H2O的电离常数为1.8×10-5mol·L-1(已知lg1.8=0.26)
C. 当加入盐酸体积为50mL时,溶液中c(NH4+)-c(NH3·H2O)=2×(10-5-10-9)mol·L-1
D. pH=9.26时的溶液中,NH4+的水解程度等于NH3·H2O的电离程度
【答案】D
【解析】
A.氨水与盐酸反应生成氯化铵,随加入盐酸体枳的增大,NH4+的物质的量增大、NH3·H2O的物质的量减小,表示NH3·H2O物质的量分数变化的曲线是A,故A正确;
B.根据图象,![]() 时,PH=9.26,
时,PH=9.26,![]() ,故B正确;
,故B正确;
C. 当加入盐酸体积为50mL时,氨水剩余一半,溶质为等浓度的氯化铵和NH3·H2O,此时溶液pH=9,根据电荷守恒c(NH4+)+ c(H+)= c(Cl-)+ c(OH-),根据物料守恒c(NH4+)+c(NH3·H2O)=2 c(Cl-),所以c(NH4+)+ 2c(H+)= c(NH3·H2O)+ 2c(OH-) , c(NH4+)-c(NH3·H2O)= 2c(OH-)-2c(H+)=2×10-5-2×10-9,故C正确;
D. pH=9.26时的溶液中,NH4+的浓度等于NH3·H2O的浓度,但水解和电离程度不同,故D错误,答案选D。

【题目】在2 L密闭容器中,800 ℃时,反应2NO+O2![]() 2NO2体系中,n(NO)随时间的变化如下表:
2NO2体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线,
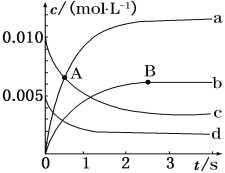
A点处,v(正)___________v(逆), A点正反应速率_________B点正反应速率。 (用“大于”、“小于”或“等于”填空)
(2)图中表示O2变化的曲线是___________。用NO2表示从0~2 s内该反应的平均速率v=____________________________。
(3) 能使该反应的反应速率增大的是____________。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4) 能说明该反应已经达到平衡状态的是___________。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)