题目内容
【题目】Ⅰ(1)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。则H2S的平衡转化率为______%,反应平衡常数K=________。
(2)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。若氨水的浓度为2.0 mol·L1,溶液中的c(OH)=_______mol·L1,0.1 mol·L1的(NH4)2SO3溶液显______(填“酸性”、“碱性”或“中性”)。
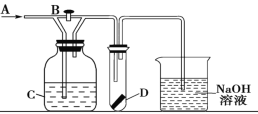
Ⅱ. 某学生用0.200mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是______ (填编号)。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______ 中(从图中选填“甲”或“乙”)。

(3)下列操作会引起实验结果偏大的是:______![]() 填编号
填编号![]() 。
。
A. 在锥形瓶装液前,留有少量蒸馏水
B. 滴定前,滴定管尖嘴有气泡,滴定后无气泡
C. 滴定终点俯视读数
【答案】2.5 2.85×10-3 6.0×10-3 碱性 ① 乙 B
【解析】
Ⅰ.(1)利用“三段式”计算平衡常数和H2S的平衡转化率;(2)根据Kb=![]() 计算c(OH);根据NH3·H2O的电离平衡常数与H2SO3的Ka2大小分析(NH4)2SO3溶液的酸碱性;Ⅱ.(1)碱式滴定管在装液前应用待装液进行润洗;(2)应将标准NaOH溶液注入碱式滴定管;(3)根据c(待测)=
计算c(OH);根据NH3·H2O的电离平衡常数与H2SO3的Ka2大小分析(NH4)2SO3溶液的酸碱性;Ⅱ.(1)碱式滴定管在装液前应用待装液进行润洗;(2)应将标准NaOH溶液注入碱式滴定管;(3)根据c(待测)=![]() 分析不当操作对V(标准)的影响;
分析不当操作对V(标准)的影响;
Ⅰ.(1)
H2S(g)+CO2(g)![]() COS(g) +H2O(g)
COS(g) +H2O(g)
开始 0.16 0.04 0 0
转化 x x x x
平衡 0.16-x 0.04-x x x
![]() ,解得x=0.004,H2S的平衡转化率为
,解得x=0.004,H2S的平衡转化率为![]() ,反应平衡常数K=
,反应平衡常数K=![]() 2.85×10-3 ;
2.85×10-3 ;
(2)Kb=![]() ,所以浓度为2.0 mol·L1溶液中的c(OH)=
,所以浓度为2.0 mol·L1溶液中的c(OH)=![]() =6.0×10-3mol/L; NH3·H2O的电离平衡常数大于H2SO3的Ka2,所以 (NH4)2SO3溶液呈碱性;
=6.0×10-3mol/L; NH3·H2O的电离平衡常数大于H2SO3的Ka2,所以 (NH4)2SO3溶液呈碱性;
Ⅱ.(1)碱式滴定管在装液前应用待装液进行润洗,所以步骤①有错误;
(2)应将标准NaOH溶液注入碱式滴定管,所以选乙;
(3)A. 在锥形瓶装液前,留有少量蒸馏水,对待测液的物质的量无影响,所以对V(标准)无影响,所测浓度无影响,故不选A; B. 滴定前,滴定管尖嘴有气泡,滴定后无气泡,V(标准)偏大,所测浓度偏大,故选B; C. 滴定终点俯视读数,V(标准)偏小,所测浓度偏小,故不选C,答案选B。

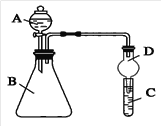
【题目】某研究小组为探究SO2和Fe(NO3)3溶液的反应的实质。设计了如下图所示装置进行实验.
已知:1.0 mol/L的Fe(NO3)3溶液的pH=1。

请回答:
(1)装置A中用于添加浓硫酸的仪器名称为__________________。
(2)实验前鼓入N2的目的是________________________________。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因。
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
①若观点1正确,除产生沉淀外,还应观察到的现象是_________________。
②按观点2,装置B中反应的离子方程式是______________________________,
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2是否正确。此时应选择的最佳试剂是(填序号)_____。
A.1 mol/L稀硝酸 |
B.1.5 mol/L Fe(NO3)2溶液 |
C.6.0 mol/L NaNO3溶液和0.2 mol/L盐酸等体积混合的溶液 |
D.3.0 mol/L NaNO3溶液和0.1mol/L硫酸等体积混合的溶液 |