题目内容
8.工业上,下列金属冶炼需要采用电解法的是( )| A. | Ag | B. | Cu | C. | Fe | D. | Mg |
分析 金属的冶炼一般有电解法、热还原法、热分解法、物理分离法.电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得.
解答 解:A.Ag用加热分解氧化物的方法制得,故A不选;
B.Cu常用还原剂有(C、CO、H2等)还原氧化物得到,故B不选;
C.Fe常用还原剂有(C、CO、H2等)还原氧化物得到,故C不选;
D.镁性质活泼,一般用电解熔融的氯化物得到,故D选;
故选:D.
点评 本题考查了金属的冶炼,熟悉金属的活泼性及冶炼方法即可解答,题目难度不大.

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
18.下列说法正确的是( )
| A. | 谷氨酸的结构简式为: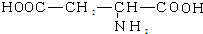 | |
| B. | 淀粉、纤维素在一定条件下都能水解生成葡萄糖 | |
| C. | 等质量的甲烷、乙烯、乙醇分别充分燃烧,所耗用氧气的量相等 | |
| D. | 聚乳酸(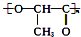 )是由单体之间通过加聚反应合成的 )是由单体之间通过加聚反应合成的 |
19.下列图象分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法中正确的是( )
| A. | 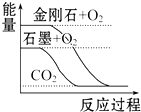 石墨转变为金刚石是吸热反应 | |
| B. | 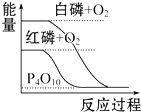 白磷比红磷稳定 | |
| C. | 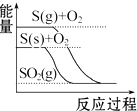 S(g)+O2(g)═SO2(g)△H1 S(s)+O2(g)═SO2(g)△H2 则△H1>△H2 | |
| D. | 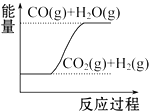 CO(g)+H2O(g)═CO2(g)+H2(g)△H1>0 |
16.香花石被誉为“矿石熊猫”,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍.下列说法错误的是( )
| A. | 原子半径:Y>Z>R>T | |
| B. | XR2、WR2两化合物中R的化合价相同 | |
| C. | 最高价氧化物对应的水化物碱性:X>Z | |
| D. | 气态氢化物的稳定性:W<R<T |
3.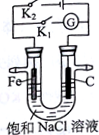 如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )
 如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )| A. | K1闭合,向铁棒附近滴入K3[Fe(CN)6]溶液,有蓝色沉淀出现 | |
| B. | K1闭合,电流方向由铁棒经导线流向石墨棒 | |
| C. | K2闭合,碳棒是阴极 | |
| D. | K2闭合,电路中通过0.2NA个电子时,两极共产生4.48L气体 |
13.如图是某烃分子的球棍模型.关于该烃的说法正确的是( )
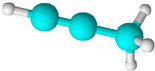

| A. | 结构简式为CH3CCH | B. | 所有原子位于同一平面内 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 一定条件下,能发生缩聚反应 |
20.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.用下面的反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH$\frac{\underline{\;0-20℃\;}}{\;}$2K2FeO4+6KCl+8H2O,对于该反应,下列说法正确的是( )
| A. | Cl2作氧化剂,发生还原反应 | |
| B. | 钾元素化合价降低 | |
| C. | 该反应是置换反应 | |
| D. | 每生成2 mol K2FeO4,转移3 mol电子 |
17.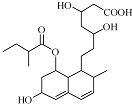 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )
 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )| A. | 能与FeCl3 溶液发生显色反应 | |
| B. | 能使溴的CCl4溶液褪色 | |
| C. | 能发生加成、取代、消去反应 | |
| D. | 1 mol 该物质最多可与1 mol NaOH 反应 |