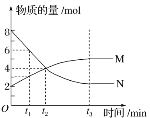
题目内容
【题目】下列离子方程式不正确的是
A.Ba(OH)2溶液中滴加NaHSO4至完全沉淀:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.漂白粉的生产原理:2OH-+Cl2=Cl-+ClO-+H2O
C.二氧化硫通入溴水中,溴水褪色:SO2+Br2+2H2O=4H++2Br-+SO42-
D.AlCl3溶液加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【答案】B
【解析】
A. Ba(OH)2溶液中滴加NaHSO4至完全沉淀,假设Ba(OH)2物质的量为1mol,则沉淀完全时,加入1molNaHSO4,此时氢离子和氢氧根离子参与反应物质的量均为1mol,离子方程式正确,故A正确;
B. 氯气与石灰乳反应生成漂白粉,石灰乳不能拆,正确的离子方程式为:![]() ,故B错误;
,故B错误;
C. 二氧化硫通入溴水中,溴单质与二氧化硫发生氧化还原反应,溴单质被还原为溴离子,二氧化硫被氧化为硫酸根离子,离子方程式正确,故C正确;
D. AlCl3溶液加入过量的氨水,发生复分解反应,生成氢氧化铝沉淀,氢氧化铝不能溶与弱碱,离子方程式正确,故D正确;
故选B。

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目