题目内容
【题目】常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入少量NaOH固体,平衡向右移动,c(H+)减小
B.加入少量CH3COONa固体,平衡向右移动
C.加入水时,平衡向右移动,CH3COOH电离常数增大
D.加入少量pH=5的硫酸,溶液中c(H+)增大
【答案】A
【解析】
A. 加入少量NaOH固体,消耗氢离子, c(H+)减小,CH3COOH![]() CH3COO-+H+向右移动,故A正确;
CH3COO-+H+向右移动,故A正确;
B. 加入少量CH3COONa固体,CH3COO-浓度增大,平衡向左移动,故B错误;
C. 电离平衡常数只与温度有关,加入水时,平衡向右移动,CH3COOH电离常数不变,故C错误;
D. 加入少量pH=5的硫酸,醋酸电离平衡不移动,溶液中c(H+)不变,故D错误;

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】某实验小组用0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸进行中和热的测定,测定稀硫酸和稀氢氧化钠溶液反应的中和热的实验装置如图所示:

(1)仪器A的名称为___。
(2)装置中碎泡沫塑料的作用是___。
(3)写出表示该反应中和热的热化学方程式(中和热为57.3kJ·mol-1):___。
(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
1 | H2SO4 | NaOH | 平均值 | ||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差平均值为___℃。
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·(g·℃)-1。则中和热△H=-53.5kJ/mol。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度
【题目】近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)在2L的密闭容器中,充有2mol CO与4mol 水蒸气,在催化剂作用下进行如下化学反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
t(℃) | 750 | 850 | 1000 |
CO% | 0.7 | 2/3 | 0.5 |
1000℃时该反应的平衡常数为___________________。850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此时反应___________(填“向右进行”、“向左进行”或“处于平衡状态”)。
(2)已知:
C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
则CO和H2O生成CO2和H2的热化学方程式为_________________________。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
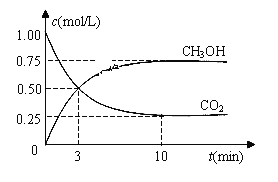
①从反应开始到平衡,氢气的平均反应速率v(H2)=_________
②若改变条件使平衡向正反应方向移动,则平衡常数_________
a.不变 b.减小 c.增大 d.不变或减小 e.不变或增大