题目内容
【题目】近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)在2L的密闭容器中,充有2mol CO与4mol 水蒸气,在催化剂作用下进行如下化学反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
t(℃) | 750 | 850 | 1000 |
CO% | 0.7 | 2/3 | 0.5 |
1000℃时该反应的平衡常数为___________________。850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此时反应___________(填“向右进行”、“向左进行”或“处于平衡状态”)。
(2)已知:
C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
则CO和H2O生成CO2和H2的热化学方程式为_________________________。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
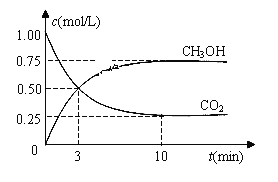
①从反应开始到平衡,氢气的平均反应速率v(H2)=_________
②若改变条件使平衡向正反应方向移动,则平衡常数_________
a.不变 b.减小 c.增大 d.不变或减小 e.不变或增大
【答案】![]() 向右进行 CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2 kJ/mol 0.225mol·L-1·min-1 e
向右进行 CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2 kJ/mol 0.225mol·L-1·min-1 e
【解析】
(1)利用三段式,分别计算1000℃、850℃时的平衡常数,根据Q与K的关系判断反应方向;
(2) 根据盖斯定律计算CO和H2O生成CO2和H2的焓变;
(3) ① 根据![]() 计算v(H2);
计算v(H2);
②根据影响平衡常数的因素分析;
(1) 1000℃时,CO平衡转化率为0.5
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始 1 2 0 0
转化 0.5 0.5 0.5 0.5
平衡 0.5 1.5 0.5 0.5
1000℃时,![]()
![]() ;
;
850℃时,CO平衡转化率为![]()
CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
开始1 2 0 0
转化![]()
![]()
![]()
![]()
平衡 ![]()
![]()
![]()
![]()
850℃时, 1;850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,
1;850℃时,向该容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,![]() =
=![]() ,Q<K,反应向右进行;
,Q<K,反应向右进行;
(2) ①C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
②2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol1
③C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
根据盖斯定律 ①-②-③得CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41.2 kJ/mol;
(3) ① 根据图像,甲醇的浓度变化量为0.75mol/L,则氢气的浓度变化量为0.75mol/L×3=2.25 mol/L, ![]() 0.225mol·L-1·min-1;
0.225mol·L-1·min-1;
②平衡常数只与温度有关,若改变温度平衡正向移动,则平衡常数增大,若改变其它因素平衡正向移动,则平衡常数不变,故选e;

【题目】在T ℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
序号 | NaOH溶液体积 | 盐酸体积 | 溶液pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A.1B.6C.5D.4