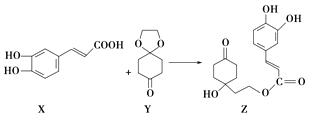
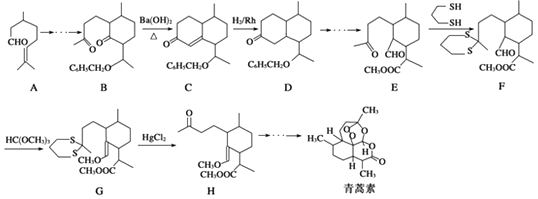
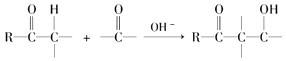题目内容
【题目】下表列出了 a~m 13种元素在周期表(已省略了过渡元素)中的位置:
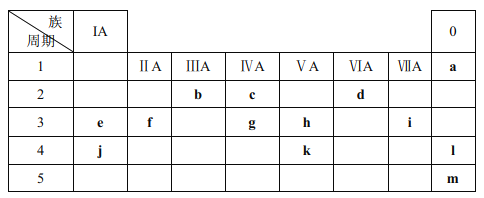
(1)元素 b为______(填名称);画出 g 的原子结构示意图______。
(2)元素 f、i、j 的原子半径从大到小的顺序是______ (用元素符号表示);这三种原子分别形成简单离子后,离子半径从大到小的顺序是______ (用离子符号表示)。
(3) h 和 k 的原子序数相差______ (填数字)。
(4)元素d和e形成的一种化合物为淡黄色固体,该化合物的电子式为_____________,该化合物中化学键有______,该化合物与c的最高价氧化物反应的化学方程式为________________________ 。
(5)人们曾认为, a、l、m 的单质不发生化学反应, 曾把它们叫做“惰性气体”。 但后来发现这族气体有的可参加化学反应,a、l、m中最有可能首先被发现可以形成化合物的元素是__________(写元素符号)。
(6)用高能射线照射含有 10 电子的 d 元素氢化物分子时,一个分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式:______。
【答案】 硼 略 K、 Mg 、Cl Cl- 、K+ 、Mg2+ 18  离子键、(非极性)共价键 2Na2O2 + 2CO2 = 2Na2CO3+ O2 Xe 略
离子键、(非极性)共价键 2Na2O2 + 2CO2 = 2Na2CO3+ O2 Xe 略
【解析】由元素在周期表中的位置可以知道a、b、c、d、e、f、g、h、i、j、k、l、m分别为He、B、C、O、Na、Mg、Si、P、Cl、K、As、Kr、Xe等元素,(1)b在第2周期IIA族为硼,g在第3周期IVA族为硅;(2) 同周期从左到右原子半径逐渐减小;同周期阴离子半径大于阳离子半径,核外电子排布相同的离子,核电荷数越大,离子半径越小;(3)P在第3周期VA族,As在第4周期VA族;(4)过氧化钠为淡黄色固体,为含有共价键的离子化合物,过氧化钠和二氧化碳反应生成碳酸钠和氧气;(5)同族元素从上到下金属逐渐增强,和F2更容易反应;(6) 用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,电子式为:![]() 。
。
由元素在周期表中的位置可以知道a、b、c、d、e、f、g、h、i、j、k、l、m分别为He、B、C、O、Na、Mg、Si、P、Cl、K、As、Kr、Xe等元素,
(1)元素 b为硼; g 的原子结构示意图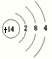 。故答案为:硼 ;
。故答案为:硼 ; 。
。
(2)元素 f、i、j 的原子半径从大到小的顺序是K、 Mg 、Cl;这三种原子分别形成简单离子后,离子半径从大到小的顺序是Cl- 、K+ 、Mg2+。故答案为:K、 Mg 、Cl; Cl- 、K+ 、Mg2+
(3) P在第3周期VA族,As在第4周期VA族, P 和 As 的原子序数相差18。
(4)元素O和Na形成的一种化合物为淡黄色固体为过氧化钠,过氧化钠的电子式为 ,其中化学键有离子键、(非极性)共价键,该化合物与CO2反应的化学方程式为2Na2O2 + 2CO2 = 2Na2CO3+ O2。
,其中化学键有离子键、(非极性)共价键,该化合物与CO2反应的化学方程式为2Na2O2 + 2CO2 = 2Na2CO3+ O2。
(5)根据同族元素性质递变规律,He、Kr、Xe中最有可能首先被发现可以形成化合物的元素是Xe。
(6) 用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,电子式为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案