��Ŀ����
����Ŀ��1828�꣬�¹���ѧ�Ҹ������ϣ��ά���״�ʹ��(NH4)2SO4�������KCNO�˹��ϳ�������CO(NH2)2���������л��������"������"ѧ˵��
��1�� (NH4)2SO4��KCNO�ϳ����ط�Ӧ�Ļ�ѧ����ʽΪ____________��
��2��ijС��ͬѧ��ʵ���������£�����CO2��NH3���ڴ����������ºϳ�������
����CO2��NH3�ϳ����� CO(NH2)2��Ӧ�Ļ�ѧ����ʽΪ____________��
��ʵ�������CO2���ö���װ�����Ʊ���Ҫ��ﵽ���濪���á������ͣ����Ŀ�ģ�����װ��A��B��C��D��E�з���Ҫ�����____________������ĸ����
������Fװ���ռ�������������Ӧ�ɵ��ܿ�____________������a������b�������롣




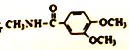
��3��������Ʒ�е����������ü�ȩ���궨����ԭ�����£�������Ũ����ֽ�������ʹ��Һ�еİ���������鱗��ų�������̼���������������кͺ�õ�������Σ����ü�ȩ��HCHO��������������������μ����������(CH2)6N4H+���������ñ�����������Һ�ζ���
�ټ�ȩ������立�Ӧ�����ӷ���ʽΪ____________��
�ڵζ�ѡ�õ�ָʾ��Ϊ____________���ζ��յ������Ϊ____________��
������ȡ��Ʒm g���ܽ�����250mL��Һ��ȡ25.00mL��Ʒ��Һ��250 mL��ƿ�У�����10mL w%�ļ�ȩ��Һ����ַ�Ӧ����1��2��ָʾ������Ũ��Ϊa mol/L��NaOH����Һ�ζ����յ㣨��֪�ζ�ʱ��1 mol���μ����������(CH2)6N4H+����OH����������1mol H+�൱�����ظ�2�Σ�����NaOH����Һ�����ƽ��ֵΪb mL�������Ʒ�е�����������Ϊ____________��
���𰸡� (NH4)2SO4+2KCNO=2CO(NH2)2+K2SO4 CO2+2NH3=CO(NH2)2+H2O BCD b 4NH4++6HCHO =(CH2)6N4H++3H++ 6H2O ��̪ �������һ�α�Һʱ��ƿ����Һ��ɫ��dz��ɫ�Ұ�����ڲ���ɫ ![]()
��������(1) (NH4)2SO4��KCNO�ϳ����صĻ�ѧ����ʽΪ(NH4)2SO4+2KCNO=2CO(NH2)2+K2SO4
(2) ����CO2��NH3�ϳ����صĻ�ѧ����ʽΪCO2+2NH3=CO(NH2)2+H2O�����Ʊ�CO2����װ���ж��֣�Ҫ��ﵽ���濪���á������ͣ����Ŀ�Ŀ�ѡ��BCD��Aװ�õ��رյ��ɼк����岻�ܰ�Һ���ų�����Ӧ����ֹͣ����������ѹ�������б�ը�¹ʷ����Ŀ�����Bװ�õ��رյ��ɼк����彫Һ��ѹ�볤��©���ڣ�ʹ������Һ������ֹͣ��Ӧ��Cװ�ùرջ��������彫Һ��ѹ���ձ��ڣ�ʹ������Һ������ֹͣ��Ӧ��Dװ�õ��رջ��������彫Һ���U���ұ�ѹ����ߣ�ʹ������Һ������ֹͣ��Ӧ��Eװ�õ��رշ�Һ©��������Ӧ��������ֹͣ������������ĿҪ������������Ҫ���װ����BCD�����������ڰ������ܶ�С�ڿ������Ҽ�������ˮ������ֻ���������������ռ������װ��F�Ľṹ������Ӧ��b�ڽ��롣
(3)�ٸ�����Ŀ������֪����ȩ������立�Ӧ�������μ����������(CH2)6N4H+�����ᣬ���Է�Ӧ�����ӷ���ʽΪ4NH4++6HCHO =(CH2)6N4H++3H++ 6H2O��������ñ�����������Һ�ζ���Ӧ���ɵ��������ʣ�����Ӧ�÷�̪��ָʾ�����ζ��յ������Ϊ�������һ�α�Һʱ��ƿ����Һ��ɫ����ɫ��Ϊ�ۺ�ɫ�Ұ�����ڲ���ɫ����1 mol���μ����������(CH2)6N4H+����OH����������1mol H+�൱�����������й�ϵ4NH4+~ [(CH2)6N4H+ +3H+] ~ 4OH������NH4+~ OH������֪n(OH��)= a mol/L��b��10-3L��![]() = n(NH4+)= n(N)= ab��10-2mol�������Ʒ�е�����������Ϊ=
= n(NH4+)= n(N)= ab��10-2mol�������Ʒ�е�����������Ϊ= ![]()

 ��һ����ͬ���ɽ�����ϵ�д�
��һ����ͬ���ɽ�����ϵ�д� ������Ӧ���ϵ�д�
������Ӧ���ϵ�д�����Ŀ��Ԫ���ǹ������������������һ�����ʵġ�ԭ���ϡ���
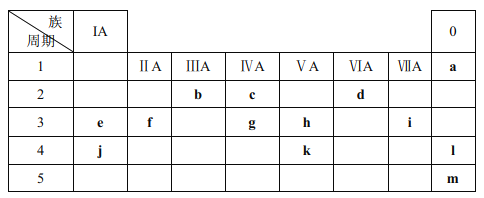
��1����18������������ѧ���Dz���̽��Ԫ��֮�ա�ͨ���Ӿֲ���ϵͳ���о����̣�������Ԫ��֮���������ϵ�������г��˼�λ�ܳ���ѧ�ҵ��о�������
��� | �� | �� | �� | �� |
��ѧ | Ŧ���� | ������ | �±����� | �йŶ��� |
���� | ���֡�����������ָ����ijһָ����Ԫ���𣬵ڰ˸�Ԫ���ǵ�һ��Ԫ�ص�ij���ظ� | ��������ԭ���������ȿ�ʼ���ԭ�������IJⶨ���� | ������5���������Ƶġ���Ԫ���������м�Ԫ�ص����ԭ������Ϊǰ������Ԫ�����ԭ������������ƽ��ֵ | ��Ϊ��Ԫ����֮�䲢�Ǻ�����أ����������ԭ�����������ǰ���С�����˳���� |
������ѧ�ҵ��о�����ʱ���Ⱥ������������_________����������ţ���
��2��1869�꣬�Ž��з���ǰ���о��Ļ������Ƴ��˵�һ��Ԫ�����ڱ�����ͼ��ʾ��
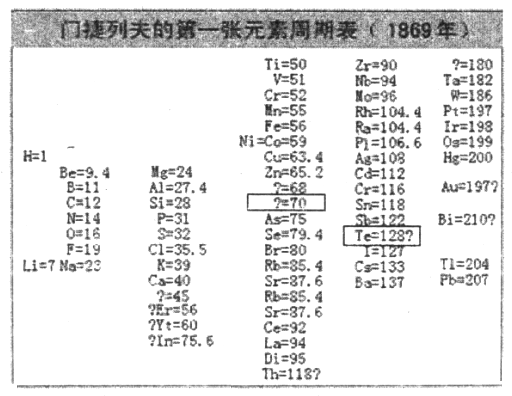
���Ž��з�����Ԫ�ذ������ԭ����������ͬһ___________������С������С���Ԫ���������ơ���ϱ�����Ϣ�������4�з����С�����70�����ʺű���ĺ�����_______________����5�з����С�Te��128�������ʺű���ĺ�����_______________��
�ڵ�20���ͳ����Ž��з����ڱ���Ϊδ֪Ԫ�����µĿ�λ�����������ң�����ԭ�ӽṹ�����أ���ѧ���Ƿ�����Ԫ�����ʲ����������ԭ�������������������Ա仯����������ԭ���������˵�������������������Ա仯���䱾��ԭ����_______________������ĸ��ţ���
A. ���ź˵����������ԭ�Ӻ�������Ų����������Ա仯
B. ���ź˵����������ԭ�Ӱ뾶���������Ա仯
C. ���ź˵����������Ԫ����Ҫ���ϼ۳��������Ա仯
��3��������Ԫ��A��B��D��E��G��J�����ڱ��е�λ�����£�
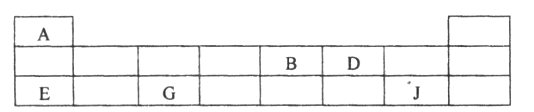
�����ϱ��ش����⣺
��D�����ڱ��е�λ����_______________��
��A��B��E��G��ԭ�Ӱ뾶�ɴ�С��˳����_______________����Ԫ�ط��ţ���
��B��D����̬�⻯����ȶ��Դ�С��ϵΪ_______________���ѧʽ����
��E��G��J������������Ӧˮ��������֮�䷴Ӧ�����ӷ���ʽ�ֱ�Ϊi. H����OH����H2O��ii. _______________��iii_______________��
���õ���ʽ��ʾE�������������γɹ���_______________��
����Ŀ��̼��������Ԫ�ؼ��仯���������������������������ء�
I��̼�Ļ������ת���������������о�����Ҫ��Ӧ�á��ر���CO2�ĵ�̼ת�ͶԵ�������仯������Ҫ���塣

�������ݻ���Ϊ1L���ܱ��������Բ�ͬ����̼��n(H2)/n(CO2)����H2��CO2����һ�������·�����Ӧ��
2CO2(g) + 6H2(g) ![]() C2H4(g) + 4H2O(g) ��H��CO2��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ���١��ڡ�2.0�ֱ����������̼��ʱ�ı仯����)��
C2H4(g) + 4H2O(g) ��H��CO2��ƽ��ת�������¶ȵĹ�ϵ��ͼ��ʾ���١��ڡ�2.0�ֱ����������̼��ʱ�ı仯����)��
��ش��������⣺
��1����Ӧ�ġ�H_____0����̼����________�ڣ�Q��v(��)_____v(��)(����ڡ���С�ڡ�)
��2������ʼʱ��CO2��Ũ��Ϊ0.5mol/L��������Ũ��Ϊ1.0mol/L����P���Ӧ�¶ȵ�ƽ�ⳣ����ֵΪ_____________________��
II���ȵĻ�����ϳɡ�ת��һֱ�ǿ�ѧ�о����ȵ㡣
��һ�������£������백����Ӧ�����Ʊ��Ȱ�[NH2Cl(g)]����֪���ֻ�ѧ���ļ��ܣ�
��������Ӧ���Ȼ�ѧ����ʽΪ_______________________________________________________��
��ѧ�� | N��H | Cl��Cl | N��Cl | H��Cl |
����/kJ��mol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
���Ȱ���һ�ֳ�Ч���ͺ������������л������־õ�ɱ�����ã�����ɱ��H7N9�����в�����������ԭ��Ϊ��ˮ������Ӧ����ǿ�����Ե����ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ
_________________________________________________________��
III���ð�ˮ��ȥSO2
(1)��֪25��ʱ��NH3��H2O��Kb=1.8��10-5��H2SO3��Ka1=1.3��10-2��Ka2=6.2��10-8.����ˮ��Ũ��Ϊ2.0mol/L������Һ�е�c(OH-)=_________mol/L.��SO2ͨ��ð�ˮ�У���c(OH-)����1.0��10-7mol/Lʱ����Һ�е�c(SO32-)/c(HSO3-)=_____________.
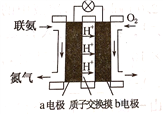
(2)���ð������������������ȡ����N2H4.��ͼ���ɡ�����-�������γɵ���ɫȼ�ϵ��,��ʯīΪ�缫�ĵ�ع���ԭ��ʾ��ͼ,b�缫Ϊ____________��(���������),д���õ�ع���ʱa�缫�ĵ缫��Ӧʽ___________________________________________.