题目内容
下列有关实验现象和解释或结论都正确的是
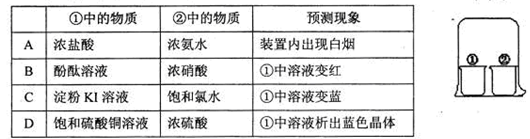
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 N2O4的△H<0 N2O4的△H<0 |
| D | 向AgCl沉淀中滴加KI溶液 | 白色沉淀变为黄色 | 溶度积:AgI比AgCl更小 |
D
解析试题分析:二氧化硫是酸性氧化物,易溶于水,与水反应生成亚硫酸,则二氧化硫气体能使紫色石蕊试液变红,但是不能褪色,证明二氧化硫具有酸性氧化物的性质,故A错误;浓硫酸具有酸性、脱水性,能使pH试纸先变红后变黑,因为它能使纤维素脱水炭化,证明它具有酸性和脱水性,故B错误;红棕色的二氧化氮气体变为无色的四氧化二氮气体是放热反应,升高温度平衡向吸热反应方向移动,则玻璃球内气体红棕色变深,而不是变浅,故C错误;溶解度小的沉淀转化为溶解度更小的沉淀容易实现,白色的氯化银沉淀变为黄色的碘化银沉淀,说明溶解度:AgI<AgCl,故D正确。
考点:考查化学实验方案的设计与评价,涉及元素化合物的主要性质、温度对化学平衡的影响、沉淀的转化规律等。

练习册系列答案
相关题目
下列关于元素及其化合物的说法正确的是
| A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应 |
| B.Na久置于空气中,可以和空气中的有关物质发生反应,最终生成NaHCO3 |
| C.S、Cl2均能和NaOH溶液发生氧化还原反应,且都既作氧化剂又作还原剂 |
| D.因为碳酸、氨水能够导电,所以液氨、二氧化碳是电解质 |
下列实验和结论不正确的是
| A.明矾和漂白粉均可用于自来水的杀菌、消毒 |
| B.用丁达尔实验可以将Al(OH)3胶体和NaCl溶液区分 |
| C.向KI溶液滴加氯水和CCl4振荡,静置后分层且下层显紫色,则氧化性:Cl2>I2 |
| D.Al(OH)3与稀H2SO4、NaOH溶液均能反应,说明AI(OH)3是两性氢氧化物 |
下列有关说法不正确的是
| A.明矾净化水是因为明矾的水解产物有吸附作用 |
| B.FeCl3溶液腐蚀铜电路板的过程发生了置换反应 |
| C.氨氧化法制硝酸的过程中有NO2生成 |
| D.氯碱工业中,NaOH是在阴极室中产生的 |
下列陈述I、II正确并且有因果关系的是( )
| 选项 | 陈述I | 陈述II |
| A | Fe2(SO4)3可以做净水剂 | Fe 3+水解成胶体可吸附水中的细小悬浮物 |
| B | 向Ba(NO3)2溶液中通入足量SO2,无明显现象 | 弱酸不能制强酸 |
| C | Cl2能使湿润的布条褪色 | Cl2具有漂白性 |
| D | 电解NaCl溶液制备金属钠 | NaCl是离子化合物 |
固体X只可能由A1、(NH4)2SO4 ,MgCl2.FeCl2, AlCl3, AgN03中的一种或几种组成,某同学对该固体进行了如下实验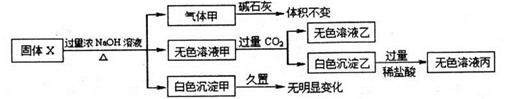
下列判断正确的是:
| A.气体甲一定是纯挣物 |
| B.白色沉淀甲可能是混合物 |
| C.固体X中一定存在AlCl3、(NH4)2SO4, MgCl2 |
| D.固体X中一定不存在FeCl2、AgNO3 |