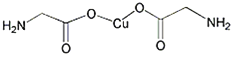
МвДїДЪИЭ
ЎѕМвДїЎїТСЦЄПВБРИИ»ЇС§·ЅіМКЅ,»ШґрПВБРОКМвЈє
ўЩ2H2ЈЁgЈ©+O2ЈЁgЈ©=2H2OЈЁlЈ© ¦¤H=©Ѓ570kJ![]()
ўЪ2H2OЈЁgЈ©=2H2ЈЁgЈ©+O2ЈЁgЈ© ¦¤H=+483.6kJ![]()
ўЫ2CЈЁsЈ©+O2ЈЁgЈ©=2COЈЁgЈ© ¦¤H=©Ѓ220.8kJ![]()
ўЬCЈЁsЈ©+O2ЈЁgЈ©=CO2ЈЁgЈ© ¦¤H=©Ѓ393.5kJ![]()
ЈЁ1Ј©ЙПКц·ґУ¦ЦРКфУЪ·ЕИИ·ґУ¦µДКЗ_____ЈЁМоРґРтєЕЈ©Ј»
ЈЁ2Ј©H2µДИјЙХИИОЄ_____Ј»
ЈЁ3Ј©ИјЙХ8g H2ЙъіЙТєМ¬Л®Ј¬·ЕіцµДИИБїОЄ_____Ј»
ЈЁ4Ј©H2OЈЁlЈ©=H2OЈЁgЈ©¦¤H=______Ј»
ЈЁ5Ј©COµДИјЙХИИµДИИ»ЇС§·ЅіМКЅОЄ__ЎЈ
Ўѕґр°ёЎїўЩўЫўЬ 285kJmol-1 1140kJ +43.2kJmol-1 COЈЁgЈ©+![]() O2ЈЁgЈ©=CO2ЈЁgЈ©¦¤H=©Ѓ283.1kJmol-1
O2ЈЁgЈ©=CO2ЈЁgЈ©¦¤H=©Ѓ283.1kJmol-1
ЎѕЅвОцЎї
ўЩЎчHЈј0К±·ґУ¦ОЄ·ЕИИ·ґУ¦Ј¬№КўЩўЫўЬѕщОЄ·ЕИИ·ґУ¦ЎЈ
№Кґр°ёОЄўЩўЫўЬ
ўЪH2µДИјЙХИИКЗ1 molЗвЖшНкИ«ИјЙХЙъіЙОИ¶ЁСх»ЇОпТєМ¬Л®К±Лщ·ЕіцµДИИБїЈ¬ўЩ2H2ЈЁgЈ©+O2ЈЁgЈ©=2H2OЈЁlЈ©ЎчH=-570kJmol-1Ј¬ТАѕЭёЗЛ№¶ЁВЙ,ЗвЖшµДИјЙХИИОЄ0.5ЎБўЩ=285kJmol-1ЎЈ
№Кґр°ёОЄ285kJmol-1
ўЫИјЙХ8gH2ЙъіЙТєМ¬Л®Ј¬·ЕіцµДИИБїОЄxЈ¬ёщѕЭПВБРИИ»ЇС§·ЅіМКЅјЖЛгЈє
2H2ЈЁgЈ©+O2 ЈЁgЈ©=2H2OЈЁlЈ©Ј»ЎчH=-570kJ?mol-1
4g 570KJ
8g x
x=1140KJЈ»
№Кґр°ёОЄ1140KJЎЈ
ўЬУЙёЗЛ№¶ЁВЙµГH2OЈЁlЈ©=H2OЈЁgЈ©¦¤H=ЎЄ0.5ЈЁўЩЈ«ўЪЈ©=+43.2kJmol-1
№Кґр°ёОЄ+43.2kJmol-1
ўЭТАѕЭёЗЛ№¶ЁВЙЈЁўЬЎБ2-ўЫЈ©ЎБ0.5µГµЅЈєCOЈЁgЈ©+![]() O2ЈЁgЈ©=CO2ЈЁgЈ©ЎчH= - 283KJ/mol
O2ЈЁgЈ©=CO2ЈЁgЈ©ЎчH= - 283KJ/mol
№Кґр°ёОЄЈєCOЈЁgЈ©+![]() O2ЈЁgЈ©=CO2ЈЁgЈ©ЎчH=-283KJ/molЈ»
O2ЈЁgЈ©=CO2ЈЁgЈ©ЎчH=-283KJ/molЈ»

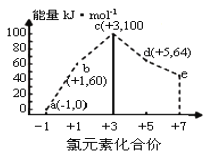
ЎѕМвДїЎїПВБРёчЧйОпЦКЦРЈ¬І»ВъЧгЧйДЪИОТвБЅЦЦОпЦКФЪТ»¶ЁМхјюПВѕщДЬ·ўЙъ·ґУ¦µДКЗ
јЧ | ТТ | ±ы | |
A |
| HCl | NaOH |
B |
| NaOH | HF |
C | HCl | NaOH |
|
D |
|
|
|
A.AB.BC.CD.D
ЎѕМвДїЎїЈЁ1Ј©ТСЦЄФЪ2LµДГЬ±ХИЭЖчЦРЅшРРИзПВїЙДж·ґУ¦Ј¬ёчОпЦКµДУР№ШКэѕЭИзПВЈє
aA(g) |
| bB(g) |
| 2C(g) | |
ЖрКјОпЦКµДБїЕЁ¶И/(molЎ¤L-1)Јє | 1.5 | 1 | 0 | ||
2sД©ОпЦКµДБїЕЁ¶И/(molЎ¤L-1)Јє | 0.9 | 0.8 | 0.4 |
Зл»ШґрПВБРОКМвЎЈ
ўЩёГїЙДж·ґУ¦µД»ЇС§·ЅіМКЅїЙ±нКѕОЄ__ЎЈ
ўЪУГОпЦКBАґ±нКѕ0Ў«2sµДЖЅѕщ·ґУ¦ЛЩВКОЄ__ЎЈ
ўЫґУ·ґУ¦їЄКјµЅ2sД©Ј¬AµДЧЄ»ЇВКОЄ__ЎЈ
ўЬПВБРКВКµДЬ№»ЛµГчЙПКц·ґУ¦ФЪёГМхјюПВТСѕґпµЅ»ЇС§ЖЅєвЧґМ¬µДКЗ__ЈЁМоРтєЕЈ©
A.vBЈЁПыєДЈ©=vCЈЁЙъіЙЈ©
B.ИЭЖчДЪЖшМеµДЧЬС№Зї±ЈіЦІ»±д
C.ИЭЖчДЪЖшМеµДГЬ¶ИІ»±д
D.vAЈєvBЈєvC=3Јє1Јє2
E.ИЭЖчДЪЖшМеCµДОпЦКµДБї·ЦКэ±ЈіЦІ»±д
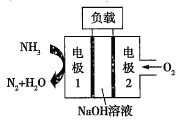
ЈЁ2Ј©ўЩРїµзіШУРНыґъМжЗ¦РоµзіШЈ¬ЛьµД№№іЙІДБПКЗРїЎўїХЖшЎўДіЦЦµзЅвЦКИЬТєЈ¬·ўЙъµДЧЬ·ґУ¦·ЅіМКЅКЗ2Zn+O2=2ZnOЎЈФтёГµзіШµДёєј«ІДБПКЗ__ЎЈ
ўЪИрµдASES№«ЛѕЙијЖµДФшУГУЪЗэ¶ЇЗ±Н§µДТє°±-ТєСхИјБПµзіШµДКѕТвНјИзНјЈ¬ёГИјБПµзіШ№¤ЧчК±Ј¬µзіШµДЧЬ·ґУ¦·ЅіМКЅОЄ__Ј»ёєј«µДµзј«·ґУ¦КЅОЄ__ЎЈ