题目内容
【题目】一定条件下,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )
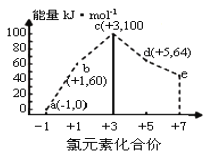
A.b→a+c反应的活化能为生成物总能量减反应物总能量
B.b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq) ΔH=-116kJmol-1
C.a、b、c、d、e中,c最稳定
D.一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶2∶1
【答案】B
【解析】
A.依据图中数据无法判断![]() 反应的活化能,故A错误;
反应的活化能,故A错误;
B.![]() ,根据转移电子守恒得该反应方程式为
,根据转移电子守恒得该反应方程式为![]() ,反应热
,反应热![]() ,所以该热化学反应方程式为
,所以该热化学反应方程式为![]() ,故B正确;
,故B正确;
C.根据图示信息,氯元素的化合价越高,物质具有的能量先是升高后是降低,所以a,b,c,d,e中a最稳定,故C错误;
D.氧化还原反应要满足得失电子数守恒,而![]() 与NaOH溶液反应生成的产物有a、b、d,即
与NaOH溶液反应生成的产物有a、b、d,即![]() 、
、![]() 和
和![]() 时,溶液中
时,溶液中![]() 、
、![]() 和
和![]() 的浓度之比为11:2:1时,氯元素得电子为
的浓度之比为11:2:1时,氯元素得电子为![]() ,失电子为
,失电子为![]() ,得失电子数不相等,故D错误。
,得失电子数不相等,故D错误。
故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】一定温度下,在3个容积均为![]() 的恒容密闭容器中反应
的恒容密闭容器中反应![]() 达到平衡,下列说法正确的是
达到平衡,下列说法正确的是
容器 | 温度 | 物质的起始浓度 | 物质的平衡浓度 | ||
|
|
|
| ||
Ⅰ | 400 |
|
| 0 |
|
Ⅱ | 400 |
|
| 0 |
|
Ⅲ | 500 |
|
| 0 |
|
A. 该反应的正反应是吸热反应
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的小
C. 达到平衡时,容器Ⅱ中![]() 小于容器Ⅲ中
小于容器Ⅲ中![]()
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小