题目内容
19.CO和NO是汽车尾气的主要污染物.消除汽车尾气的反应式之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol ①
C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol ②
2C(s)+O2═2CO(g)△H=-221kJ/mol ③
则 2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5kJ/mol.
(2)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1414.
①该反应的平衡常数K=27Va27Va(用只含a、V的式子表示).
②判断该反应达到平衡的标志是BD(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(3)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图1所示,则:
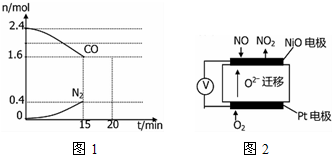
①有害气体NO的转化率是40%.
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是CD(填序号).
A.增加CO的量 B.加入催化剂 C.降低温度 D.扩大容积体积
(4)通过NOx传感器可监测NOx的含量,其工作原理如图2所示,则:NiO电极上的电极反应式为NO-2e-+O2-=NO2.
分析 (1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol ①,
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ②,
2C(s)+O2=2CO(g)△H=-221kJ/mol ③,
则根据盖斯定律可知,②×2-③-①可得:2NO(g)+2CO(g)=N2(g)+2CO2(g),反应热也进行相应的计算;
(2)①根据氮气物质的量计算生成n(CO2),再根据氮气体积分数计算平衡时混合气体总物质的量,进而确定a与b的关系,代入平衡常数表达式K=c(N2)×c2(CO2)c2(NO)×c2(CO)计算;
②可逆反应到达平衡时,正逆反应速率相等,反应各组分的浓度、含量不变,由此衍生的其它物理量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化,说明到达平衡;
(3)①发生反应:2NO+2CO=N2+2CO2,计算消耗CO物质的量,根据方程式计算消耗NO物质的量,进而计算NO转化率;
②20min时,若改变反应条件,导致CO浓度减小,可以使平衡向正反应方向移动,不能增大CO浓度、增大压强,否则到达平衡时CO浓度会增大,也可以扩大容器体积;
(4)Pt电极上通入氧气,则Pt电极是正极,发生还原反应,NiO电极是负极,NO失去电子转化为NO2.
解答 解:(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol ①,
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol ②,
2C(s)+O2=2CO(g)△H=-221kJ/mol ③,
则根据盖斯定律可知②×2-③-①可得:2NO(g)+2CO(g)=N2(g)+2CO2(g),故△H=2×(-393.5kJ/mol)-(-221kJ/mol)-(180.5kJ/mol)=-746.5kJ/mol,
故答案为:-746.5kJ/mol;
(2)①平衡时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,则根据方程式可知生成CO2是2bmol.又因为N2占平衡混合气体总体积的14,所以平衡时混合气体的总的物质的量是4b,则4bmol=bmol+2bmol+amol+2amol,解得b=3a,平衡常数K=c(N2)×c2(CO2)c2(NO)×c2(CO)=bV×(2bV)2(2aV)2×(aV)2=27Va,
故答案为:27Va;
②A.v(CO2)生成=v(CO)消耗,均表示正反应速率,所以不能说明反应达到平衡状态,故A错误;
B.总质量不变,但物质的量是变化的,因此混合气体的平均相对分子质量不再改变可以说明反应达到平衡状态,故B正确;
C.在反应过程中气体总质量和容积始终是不变的,因此密度始终是不变的,则混合气体的密度不再改变不能说明反应达到平衡状态,故C错误;
D.NO、CO、N2、CO2的物质的量浓度均不再变化,说明正逆反应速率相等,反应达到平衡状态,故D正确,
故选:BD;
(3)①发生反应:2NO+2CO=N2+2CO2,平衡时CO是1.6mol,则消耗CO是2.4mol-1.6mol=0.8mol,根据方程式可知消耗NO是0.8mol,因此有害气体NO的转化率是0.8mol2.0mol×100,
故答案为:40%;
②A.增加CO的量,CO浓度增大,故A错误;
B.加入催化剂平衡不移动,CO浓度不变,故B错误;
C.正方应是放热反应,降低温度平衡向正反应方向进行,CO浓度减小,故C正确;
D.扩大容积体积平衡向逆反应方向进行,但CO浓度仍然减小,故D正确,
故选:CD;
(4)Pt电极上通入氧气,则Pt电极是正极,发生还原反应,NiO电极是负极,NO失去电子转化为NO2,所以该电极上的电极反应式为:NO-2e-+O2-=NO2,
故答案为:NO-2e-+O2-=NO2.
点评 本题考查考查盖斯定律应用、平衡状态判断、化学平衡计算以及外界条件对平衡状态的影响和原电池应用等,是对学生综合能力的考查,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 澄清石灰水来吸收氯气:Cl2+OH-═Cl-+ClO-+H+ | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 在碳酸氢钙溶液中加入少量苛性钾溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
 关系相互转化的是( )
关系相互转化的是( )| 选项 | A | B | C | D |
| a | Fe | SiO2 | Al(OH)3 | HNO3 |
| b | FeCl3 | Na2SiO3 | NaAlO2 | NO |
| c | FeCl2 | H2SiO3 | Al2O3 | NO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 只有活泼金属与活泼非金属元素原子之间才能形成离子键 | |
| B. | Na2O2中阳离子和阴离子个数比为1:1 | |
| C. | 形成离子键的阴、阳离子间只有静电吸引力 | |
| D. | 共价键存在于共价化合物中,也可能存在于单质及离子化合物中 |
| A. | 0.1mol•L?1氨水中,c(OH-)=c(NH4+) | |
| B. | 10mL 0.02mol•L?1HCl溶液与10mL 0.02mol•L?1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 | |
| C. | 在0.1mol•L?1 CH3COONa溶液中,c(OH?)=c(CH3COOH)+c(H+) | |
| D. | 0.1mol•L?1某二元弱酸盐NaHA溶液中,c(Na+)=2c(A2?)+c(HA?)+c(H2A) |
| A. | 分子数相同 | B. | 氧原子个数相等 | C. | 氢原子个数相等 | D. | 质量相等 |