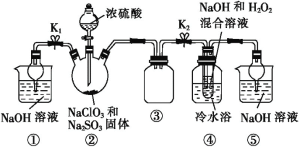
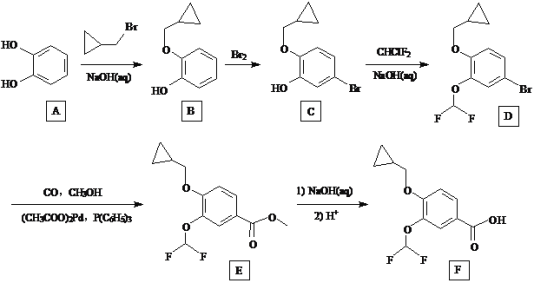
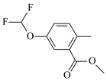
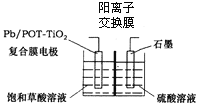
题目内容
【题目】能源、材料和信息是现代社会的三大“支柱”。
(1)目前,利用金属或合金储氢的研究已取得很大进展,图是一种镍基合金储氢后的晶胞结构图.
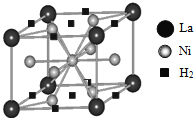
①Ni原子的价电子排布式是_____。
②该合金储氢后,含1mol La的合金可吸附![]() 的数目为_____。
的数目为_____。
(2)南师大结构化学实验室合成了一种多功能材料--对硝基苯酚水合物(化学式为![]() N
N![]() 1.5
1.5![]() O)。实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
O)。实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
①晶体中四种基本元素的电负性由大到小的顺序是_____。
②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是_____。
(3)科学家把NaN![]() 和N
和N![]() O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构.该阴离子的电子式是_____,其中心原子N的杂化方式是_____。
O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构.该阴离子的电子式是_____,其中心原子N的杂化方式是_____。
【答案】3d84s2 3NA O>N>C>H 氢键 ![]() sp3
sp3
【解析】
(1)①Ni是28号元素,其核外有28个电子,镍原子3d、4s能级上电子为其价电子,根据构造原理知Ni原子的价电子排布式为3d84s2,
故答案为:3d84s2 ;
②该晶胞中氢气分子个数=8×![]() + 2×
+ 2×![]() =3,La原子个数=8×
=3,La原子个数=8×![]() =1,所以该物质中氢分子和La原子个数比是3:1,则含1mol La的合金可吸附H2的数目为3NA,
=1,所以该物质中氢分子和La原子个数比是3:1,则含1mol La的合金可吸附H2的数目为3NA,
故答案为:3NA;
(2)①元素的非金属性越强其电负性越强,O、N、C、H的非金属性逐渐减弱,所以O、N、C、H的电负性逐渐减弱,则O、N、C、H的电负性由大到小的顺序是O>N>C>H,
故答案为:O>N>C>H;
②对硝基苯酚水合物之间氧原子和氢原子间存在氢键,所以对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是氢键,
故答案为:氢键;
(3)原子个数相等价电子数相等的微粒属于等电子体,且等电子体结构相似,阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构,则该离子是NO43-,其电子式为:![]() ,该离子中价层电子对= 4+
,该离子中价层电子对= 4+![]() (5+3-4×2)=4,所以N原子采用sp3杂化,
(5+3-4×2)=4,所以N原子采用sp3杂化,
故答案为: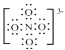 ,sp3。
,sp3。

【题目】下列实验操作、现象和所得结论都正确的是
选项 | 实验 | 现象 | 结论 |
A | 向滴有酚酞的 Na2CO3 溶液中加入少量氯化钡固体,振荡 | 溶液红色变浅 | Na2CO3溶液存在水解平衡 |
B | 向X溶液中滴加几滴新制氯水,振 荡 ,再加入少量KSCN溶液 | 溶液变为红色 | X溶液中一定含有Fe2+ |
C | 检验食盐是否加碘( KIO3), 取少量食盐溶于水,用淀粉碘化钾试纸检验 | 试纸不变蓝 | 该食盐不含有KIO3 |
D | 向蛋白质溶液中加入CuSO4或( NH4)2 SO4 的饱和溶液 | 均有沉淀生成 | 蛋白质均发生了盐析 |
A.AB.BC.CD.D