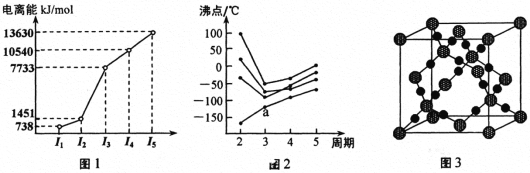
题目内容
【题目】图为CH4燃料电池的装置(A、B为多孔碳棒):

(1)____(填A或B)处电极入口通甲烷,其电极反应式为__________。
(2)该燃料电池工作时溶液中的K+向_____(填A或B)极移动。
(3)现有500 mL KNO3和Cu(N03)2的混合溶液,其中c(NO3-)=6.0mol·L-1,若以CH4燃料电池作为外接电源,且两极均用石墨作电极电解此混合溶液,工作一段时间后,电解池中两极均收集到22.4 L气体(标准状况,下同),则燃料电池消耗CH4体积为________L;假定电解后溶液体积仍为500 mL,原混合溶液中c(K+)为_______mol·L-1。
【答案】B CH4+10OH--8e-= CO32-+7H2O A 11.2 2.0
【解析】
根据原电池的工作原理及电极反应方程式书写分析解答;根据电解池的工作原理及电极反应方程式书写分析解答;根据物质的量相关计算分析解答。
(1) 根据电子流向知,B为负极、A为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,所以B处通入甲烷,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4-8e-+10OH-═CO32-+7H2O,
故答案为B;CH4-8e-+10OH-═CO32-+7H2O;
(2)原电池中,阳离子通常向正极移动,所以K+向A极移动,
故答案为A;
(3) KNO3和Cu(NO3)2的混合溶液中,阳极上的电极反应式:4OH--4e-=2H2O+O2↑,当产生22.4L即1mol(标准状况)氧气时,转移电子是4mol,根据转移电子数守恒,可知原电池中甲烷转移4mol电子,根据电极反应式可知,甲烷中的碳元素的化合价由-4升高到+4,则n(CH4)=0.5mol,即标况下为11.2L;阴极上先发生电极反应:Cu2++2e-=Cu,然后是:2H++2e-=H2↑,在阴极上生成1mol的氢气时,转移电子是2mol,所以铜离子共得到电子是2mol,根据电子得失守恒:n(Cu2+)=1mol;再根据溶液中电荷守恒,在500 mL KNO3和Cu(NO3)2的混合溶液中存在关系:2c(Cu2+)+c(K+)=c(NO3-),可以求出c(K+)=2 mol·L-1 。

【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如图:
![]()
![]()
![]()

有关物质的物理性质见表。
物质 | 沸点(℃) | 密度(g·cm3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为___________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液时反应的离子方程式__________;
②蒸馏不能分离环己酮和水的原因是____________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是_____________;
②b中水层用乙醚萃取的目的是___________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有_______,操作d中,加入NaCl固体的作用是____________。
(4)恢复至室温时,分离得到纯产品体积为6mL,则环已酮的产率____________。(计算结果精确到0.1%)
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
【题目】下表中对应关系正确的是
A | CH3CH3+Cl2 | 均为取代反应 |
B | 由油脂得到甘油 | 均发生了水解反应 |
C | Cl2+2Br=2Cl+Br2 | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O+4NaOH+O2↑ | 均为水作还原剂的氧化还原反应 |