题目内容
15.将pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液的H+ 浓度最接近于( )| A. | $\frac{1}{2}$(10-8+10-10)mol•L-1 | B. | (10-8+10-10)mol•L-1 | ||
| C. | (1×10-14-5×10-5)mol•L-1 | D. | 2×10-10mo1•L-1 |
分析 两种碱溶液混合,先根据溶液的pH计算出混合后溶液中的c(OH-),再根据常温下水的离子积Kw计算出混合液中的c(H+).
解答 解:pH=8的NaOH溶液中c(OH-)=1×10-6mol/L,pH=10的NaOH溶液中c(OH-)=1×10-4mol/L,
混合后c(OH-)=$\frac{1{0}^{-6}+1{0}^{-4}}{2}$mol/L≈$\frac{1{0}^{-4}}{2}$mol/L,
则溶液中的c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{\frac{1{0}^{-4}}{2}}$mol/L=2.0×10-10mol/L,
故选D.
点评 本题考查两种碱溶液混合后的溶液氢离子浓度计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系及计算方法,解答时要明确先计算溶液中c(OH-),再计算c(H+).

练习册系列答案
相关题目
5.下列各组顺序的排列不正确的是( )
| A. | 熔点:SiO2>CsCl>CCl4>CF4 | |
| B. | 离子半径:F->O2->Al3+>Na+ | |
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO3<HNO3 | |
| D. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 |
6. 2010年11月12日至27日,中国广州成功举办了第16届亚运会,中国代表团共获得了199枚金牌.为保证比赛成绩的公正、公平,反兴奋剂是一项重要而艰巨的工作.某种兴奋剂的结构简式如图所示.有关该物质的说法错误的是( )
2010年11月12日至27日,中国广州成功举办了第16届亚运会,中国代表团共获得了199枚金牌.为保证比赛成绩的公正、公平,反兴奋剂是一项重要而艰巨的工作.某种兴奋剂的结构简式如图所示.有关该物质的说法错误的是( )
 2010年11月12日至27日,中国广州成功举办了第16届亚运会,中国代表团共获得了199枚金牌.为保证比赛成绩的公正、公平,反兴奋剂是一项重要而艰巨的工作.某种兴奋剂的结构简式如图所示.有关该物质的说法错误的是( )
2010年11月12日至27日,中国广州成功举办了第16届亚运会,中国代表团共获得了199枚金牌.为保证比赛成绩的公正、公平,反兴奋剂是一项重要而艰巨的工作.某种兴奋剂的结构简式如图所示.有关该物质的说法错误的是( )| A. | 该有机物能与FeCl3溶液发生显色反应 | |
| B. | 一定条件下1mol该物质能与7molH2发生加成反应 | |
| C. | 该有机物分子中所有的原子不可能在同一平面 | |
| D. | 该有机物是苯酚的同系物 |
3.C6H12和C2H6O的混合物中氧的质量分数为8%,则混合物中氢的质量分数为( )
| A. | 8% | B. | 13% | C. | 14% | D. | 78% |
10.下列叙述不正确的是( )
| A. | 0.1 mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 | |
| C. | pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)相等 | |
| D. | 在NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO-)+c(H2CO3) |
20.下列实验所选装置不合适的是( )

| A. | 分离水和泥沙选① | B. | 从盐水中获得食盐选② | ||
| C. | 分离酒精和水选③ | D. | 由自来水制取纯净水选④ |
4.下列化学用语使用不正确的是( )
| A. | Na+的结构示意图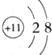 | |
| B. | 聚乙烯的结构简式为CH2=CH2 | |
| C. | 纯碱的化学式为Na2CO3 | |
| D. | 高氯酸(HClO4)中氯元素的化合价为+7 |
5.在2L的容器里有某反应物4mol,反应进行2秒后,该反应物还剩3.2mol,则该反应的平均速率为( )(mol•L-1•s-1)
| A. | 0.1 | B. | 0.2 | C. | 0.4 | D. | 0.8 |