题目内容
5.下列各组顺序的排列不正确的是( )| A. | 熔点:SiO2>CsCl>CCl4>CF4 | |
| B. | 离子半径:F->O2->Al3+>Na+ | |
| C. | 酸性强弱:H2SiO3<H2CO3<H2SO3<HNO3 | |
| D. | 碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3 |
分析 A.晶体熔沸点:原子晶体>离子晶体>分子晶体,分子晶体熔沸点与相对分子质量成正比,也受氢键影响;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强.
解答 解:A.晶体熔沸点:原子晶体>离子晶体>分子晶体,分子晶体熔沸点与相对分子质量成正比,也受氢键影响,SiO2是原子晶体、CsCl是离子晶体、CCl4和CF4是分子晶体,所以熔沸点SiO2>CsCl>CCl4>CF4,故A正确;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小,这几种离子电子层结构相同,原子序数Al>Na>F>O,所以离子半径O2->F->Na+>Al3+,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性N>S>C>Si,所以酸性强弱:H2SiO3<H2CO3<H2SO3<HNO3,故C正确;
D.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性K>Na>Mg>Al,所以碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3,故D正确;
故选B.
点评 本题考查晶体熔沸点高低判断、酸性及碱性强弱判断、离子半径大小比较等知识点,为高频考点,侧重考查元素周期律及性质分析判断能力,知道金属性、非金属性强弱判断方法及常见晶体类型即可解答,注意分子晶体熔沸点高低与化学键无关,为易错点.

练习册系列答案
相关题目
15.在一体积不变的容器中进行下列反应:2SO2+O2 $\stackrel{△}{?}$ 2SO3,表明该反应已达平衡状态的标志为( )
①SO2 的物质的量不再变化
②O2 的浓度不再变化
③容器内气体压强不再变化
④混合气体的密度不再变化
⑤SO2 的生成速率和SO2 的分解速率相等
⑥SO2 的生成速率和O2 的消耗速率相等
⑦SO3的生成速率和SO3的分解速率相等
⑧混合气体的平均相对分子质量不再变化.
①SO2 的物质的量不再变化
②O2 的浓度不再变化
③容器内气体压强不再变化
④混合气体的密度不再变化
⑤SO2 的生成速率和SO2 的分解速率相等
⑥SO2 的生成速率和O2 的消耗速率相等
⑦SO3的生成速率和SO3的分解速率相等
⑧混合气体的平均相对分子质量不再变化.
| A. | ①②③④ | B. | ④⑤⑥⑦ | C. | ①②③⑤⑦⑧ | D. | ①②⑤⑦ |
16.下列有关溶液中粒子浓度的关系式中,正确的是( )
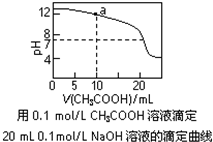

| A. | pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | 图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
13.下列属于氮的固定的是( )
| A. | N2和H2在Pt作用下反应生成NH3 | B. | NH4Cl和Ca(OH)2反应生成NH3 | ||
| C. | NO2和水制硝酸 | D. | 由NH3制氮肥 |
20.用惰性电极电解下列溶液,电解一段时间后,电解质溶液的pH上升的是( )
| A. | 饱和NaCl溶液 | B. | AgNO3 | C. | CuCl2 | D. | 饱和NaOH溶液 |
10.下列实验装置所示的实验不能达到实验目的是( )
| A. | 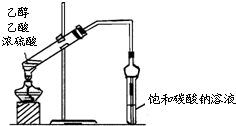 实验室制取乙酸乙酯 | B. | 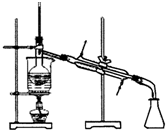 实验室蒸馏石油 | ||
| C. | 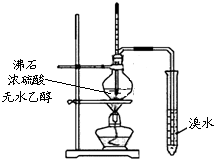 实验室制取乙烯并验证其性质 | D. | 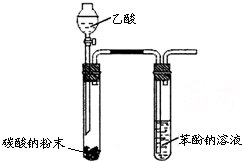 验证乙酸、碳酸、苯酚酸性强弱 |
17.下列符号中,表示两个氢原子的是( )
| A. | H2 | B. | 2H2 | C. | $\stackrel{+1}{H}$ | D. | 2H |
14.实验室常用锌片与稀H2SO4反应制取H2.下列措施中能使生成H2的速率加快的是( )
| A. | 向试管内加入水 | |
| B. | 将1mol/L的H2SO4溶液改为1.5mol/L的盐酸 | |
| C. | 将锌片改为锌粉 | |
| D. | 向试管内加少量K2SO4溶液 |
15.将pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液的H+ 浓度最接近于( )
| A. | $\frac{1}{2}$(10-8+10-10)mol•L-1 | B. | (10-8+10-10)mol•L-1 | ||
| C. | (1×10-14-5×10-5)mol•L-1 | D. | 2×10-10mo1•L-1 |