题目内容
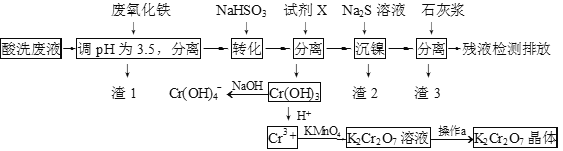
【题目】某酸性废液含有H+、Fe3+、Ni2+、NO3—、F-和Cr2O72-等。下图是该废液的综合利用工艺流程:(假设: F—与金属离子的络合反应不影响其它反应和计算)
已知:金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
[Ni(NH3)6]2+([Ni(NH3)6]2+为难电离的络合离子)
(1)滤渣1的主要成分为:____________。
(2)试剂X可以是足量氨水,还可以是:____________ 。(填序号)
A.Ni(OH)2 B.Cr2O3 C.Fe2O3 D.NaOH
(3)若试剂X是足量氨水,“沉镍”的离子方程式为:____________。
(4)经检测,最后的残液中c(Ca2+)=1.0×10─5 molL-1,则残液中F-浓度____________(填 “符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL─1]。
(5)镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
①某蓄电池反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
Fe(OH)2+Ni(OH)2,放电时若外电路中转移0.6mol电子则正极增重____g。
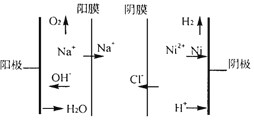
②图为双膜三室电解法处理含镍废水回收金属镍的原理示意图,阳极的电极反应式为____;电解过程中,需要控制溶液pH值为4左右,原因是_______。
【答案】Fe(OH)3 A [Ni(NH3)6]2++S2-=NiS↓+6NH3 不符合 0.6 4OH--4e-=2H2O + O2↑ pH过高时Ni2+会形成氢氧化物沉淀,pH过低时会有氢气析出,降低镍的回收率
【解析】
某酸性废液含有![]() 和
和![]() 等,在溶液中加入废氧化铁调节溶液PH=3.5,使铁离子全部沉淀,过滤得到滤渣1,滤液中加入
等,在溶液中加入废氧化铁调节溶液PH=3.5,使铁离子全部沉淀,过滤得到滤渣1,滤液中加入![]() 与
与![]() 发生反应生成铬离子,加碱沉淀铬离子形成氢氧化铬沉淀,过滤后的滤液中加入
发生反应生成铬离子,加碱沉淀铬离子形成氢氧化铬沉淀,过滤后的滤液中加入![]() 沉淀镍,过滤得到滤液中加入石灰浆沉淀得到滤渣3含有:
沉淀镍,过滤得到滤液中加入石灰浆沉淀得到滤渣3含有:![]() 和
和![]() ,氢氧化铬沉淀加酸生成铬离子,高锰酸钾将铬离子氧化为重铬酸根,结晶得到重铬酸钾晶体。
,氢氧化铬沉淀加酸生成铬离子,高锰酸钾将铬离子氧化为重铬酸根,结晶得到重铬酸钾晶体。
(1)调节溶液PH=3.5,使铁离子全部沉淀,滤渣1为![]() ,故答案为:
,故答案为:![]() ;
;
(2)据金属离子开始沉淀和沉淀完全时的pH分析,又不引入新杂质可知还可以是![]() ,故答案为:A;
,故答案为:A;
(3)若试剂X是足量氨水,![]() 与足量氨水的反应为:
与足量氨水的反应为:![]() ,加入
,加入![]() 会生成更难溶的
会生成更难溶的![]() ,“沉镍”的离子方程式为:
,“沉镍”的离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)依据溶度积常数计算F-离子浓度,![]() ,残液中
,残液中![]() ,则
,则![]()
![]() ,依据国家排放标准要求氟离子浓度小于10mgL-1分析判断,不符合国家标准,故答案为:不符合;
,依据国家排放标准要求氟离子浓度小于10mgL-1分析判断,不符合国家标准,故答案为:不符合;
(5)①![]() ,根据方程式分析正极电极反应式为:
,根据方程式分析正极电极反应式为:![]() ,转移2mol电子电极质量增加2g,故转移0.6mol电子则正极增重0.6g;故答案为:0.6;
,转移2mol电子电极质量增加2g,故转移0.6mol电子则正极增重0.6g;故答案为:0.6;
②根据图像可知,阳极氢氧根放电生成氧气,故电极反应式为:![]() ;电解过程中pH太高镍离子会沉淀,pH太低则阴极氢离子会放电生成氢气,故需要控制溶液pH值为4左右,故答案为:
;电解过程中pH太高镍离子会沉淀,pH太低则阴极氢离子会放电生成氢气,故需要控制溶液pH值为4左右,故答案为:![]() ;pH过高时
;pH过高时![]() 会形成氢氧化物沉淀,pH过低时会有氢气析出,降低镍的回收率。
会形成氢氧化物沉淀,pH过低时会有氢气析出,降低镍的回收率。

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案